„Kohlenstoffdioxid“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
refs ersetzt |
en ersetzt |
||
| Zeile 200: | Zeile 200: | ||
Kohlenstoffdioxid ist im Rahmen der Tiereuthanasie weit verbreitet.<ref name="Wallace">J. Wallace, J. Sanford, M. W. Smith und K. V. Spencer (1990): ''The assessment and control of the severity of scientific procedures on laboratory animals.'' Report of the Laboratory Animal Science Association Working Party. Laboratory Animals 24 (2), S. 97–130.</ref> In Kohlenstoffdioxid-Anlagen werden in jüngster Zeit Schweine vor der Schlachtung betäubt. Dazu werden sie in Gruppen in einem [[Paternosteraufzug]] in eine Grube hinab gelassen, die mindestens 90 % Kohlenstoffdioxid enthält, und verlieren dabei das Bewusstsein.<ref>{{Internetquelle |url=http://www.spiegel.de/spiegel/print/d-13500358.html |autor= |titel=Schlachthöfe: Tobsucht im Tiefschlaf |werk=[http://www.spiegel.de Der Spiegel] |datum=1990-10-01 |zugriff=2013-12-22}}</ref> Der Einsatz in hohen Konzentrationen für die Betäubung von Schlachtschweinen wird immer noch sehr kontrovers diskutiert. Aufgrund des Fehlens von besseren, mechanisch wirksamen Alternativen wird diese Methode immer noch toleriert. Mit wenig Einschränkungen wird Kohlenstoffdioxid für die Euthanasie von kleinen Labortieren empfohlen.<ref name="Wallace" /> |
Kohlenstoffdioxid ist im Rahmen der Tiereuthanasie weit verbreitet.<ref name="Wallace">J. Wallace, J. Sanford, M. W. Smith und K. V. Spencer (1990): ''The assessment and control of the severity of scientific procedures on laboratory animals.'' Report of the Laboratory Animal Science Association Working Party. Laboratory Animals 24 (2), S. 97–130.</ref> In Kohlenstoffdioxid-Anlagen werden in jüngster Zeit Schweine vor der Schlachtung betäubt. Dazu werden sie in Gruppen in einem [[Paternosteraufzug]] in eine Grube hinab gelassen, die mindestens 90 % Kohlenstoffdioxid enthält, und verlieren dabei das Bewusstsein.<ref>{{Internetquelle |url=http://www.spiegel.de/spiegel/print/d-13500358.html |autor= |titel=Schlachthöfe: Tobsucht im Tiefschlaf |werk=[http://www.spiegel.de Der Spiegel] |datum=1990-10-01 |zugriff=2013-12-22}}</ref> Der Einsatz in hohen Konzentrationen für die Betäubung von Schlachtschweinen wird immer noch sehr kontrovers diskutiert. Aufgrund des Fehlens von besseren, mechanisch wirksamen Alternativen wird diese Methode immer noch toleriert. Mit wenig Einschränkungen wird Kohlenstoffdioxid für die Euthanasie von kleinen Labortieren empfohlen.<ref name="Wallace" /> |
||
Kohlenstoffdioxid wird als Abführmitteln in Zäpfchen verwendet. Durch die Reaktion von [[Natriumdihydrogenphosphat]] und [[Natriumhydrogencarbonat]] während der Auflösung des Zäpfchens wird Kohlenstoffdioxid freigesetzt und dehnt den Darm, was wiederum den [[Stuhlreflex]] auslöst.<ref> |
Kohlenstoffdioxid wird als Abführmitteln in Zäpfchen verwendet. Durch die Reaktion von [[Natriumdihydrogenphosphat]] und [[Natriumhydrogencarbonat]] während der Auflösung des Zäpfchens wird Kohlenstoffdioxid freigesetzt und dehnt den Darm, was wiederum den [[Stuhlreflex]] auslöst.<ref>T. Frieling: ''Diagnostik bei anorektalen Erkrankungen.'' In: ''Praxis'' 96.7 (2007): S. 243-247.</ref> |
||
Kohlenstoffdioxid wird als [[Dünger]] in Gewächshäusern eingesetzt. Grund ist der durch den photosynthetischen Verbrauch entstehende Kohlenstoffdioxid-Mangel bei ungenügendem Nachschub an Frischluft, besonders im Winter bei geschlossener Lüftung. Dabei wird das Kohlenstoffdioxid entweder direkt als reines Gas oder als Verbrennungsprodukt aus [[Propan]] oder Erdgas eingebracht. Dadurch wird eine Kopplung von Düngung und Heizung erreicht. Die mögliche Ertragsteigerung ist abhängig davon, wie stark der Mangel an Kohlenstoffdioxid ist und wie stark das Lichtangebot für die Pflanzen ist.<ref> |
Kohlenstoffdioxid wird als [[Dünger]] in Gewächshäusern eingesetzt. Grund ist der durch den photosynthetischen Verbrauch entstehende Kohlenstoffdioxid-Mangel bei ungenügendem Nachschub an Frischluft, besonders im Winter bei geschlossener Lüftung. Dabei wird das Kohlenstoffdioxid entweder direkt als reines Gas oder als Verbrennungsprodukt aus [[Propan]] oder Erdgas eingebracht. Dadurch wird eine Kopplung von Düngung und Heizung erreicht. Die mögliche Ertragsteigerung ist abhängig davon, wie stark der Mangel an Kohlenstoffdioxid ist und wie stark das Lichtangebot für die Pflanzen ist.<ref>S. C. Wong: ''Elevated atmospheric partial pressure of CO2 and plant growth.'' In: ''Oecologia.'' 44, 1979, S. 68–74, {{DOI|10.1007/BF00346400}}.</ref> Kohlenstoffdioxid wird in der Aquaristik als Dünger für Wasserpflanzen eingesetzt (CO<sub>2</sub>-Diffusor). Durch Zufuhr von organischer Substanz kann der Kohlenstoffdioxid-Gehalt im Wasser durch Veratmung auf Kosten des Sauerstoff-Gehalts erhöht werden.<ref>{{Internetquelle |url=http://de.mongabay.com/fish/07.html |titel=Pflanzenpflege in Aquarien |werk=[http://de.mongabay.com Mongabay.com] |zugriff=2013-12-22}}</ref> |
||
Eingesetzt wird das Gas bei dem Fang [[Hämatophagie|blutsaugender]] [[Insekten]] und [[Vektor (Biologie)|Vektoren]], die das im Atem vorkommende Kohlenstoffdioxid in ihrer Wirtsfindung verwenden, wie etwa [[Stechmücken]]. Es wird dabei aus [[Trockeneis]], aus Gasflaschen oder aus der Verbrennung von Propan oder [[Butan]] freigesetzt und lockt die Insekten in die Nähe der Einsaugöffnung spezieller Fallen.<ref>Y. T. Qiu, J. Spitzen, R. S. Smallegange, B. G. J. Knols: ''Monitor systems for adult insect pests and disease vectors.'' In: W. Takken & B.G.J. Knols (Hrg.) ''Ecology and control of vector-borne diseases'', volume 1: ''Emerging pests and vector-borne diseases in Europe.'' Wagening Academic Publishers. S. 329–353, ISBN 978-90-8686-053-1</ref> |
Eingesetzt wird das Gas bei dem Fang [[Hämatophagie|blutsaugender]] [[Insekten]] und [[Vektor (Biologie)|Vektoren]], die das im Atem vorkommende Kohlenstoffdioxid in ihrer Wirtsfindung verwenden, wie etwa [[Stechmücken]]. Es wird dabei aus [[Trockeneis]], aus Gasflaschen oder aus der Verbrennung von Propan oder [[Butan]] freigesetzt und lockt die Insekten in die Nähe der Einsaugöffnung spezieller Fallen.<ref>Y. T. Qiu, J. Spitzen, R. S. Smallegange, B. G. J. Knols: ''Monitor systems for adult insect pests and disease vectors.'' In: W. Takken & B.G.J. Knols (Hrg.) ''Ecology and control of vector-borne diseases'', volume 1: ''Emerging pests and vector-borne diseases in Europe.'' Wagening Academic Publishers. S. 329–353, ISBN 978-90-8686-053-1</ref> |
||
Version vom 22. Dezember 2013, 17:40 Uhr
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Allgemeines | ||||||||||
| Name | Kohlenstoffdioxid | |||||||||
| Andere Namen | ||||||||||
| Summenformel | CO2 | |||||||||
| Kurzbeschreibung |
farbloses, geruchloses Gas[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 44,01 g·mol−1 | |||||||||
| Aggregatzustand |
gasförmig | |||||||||
| Dichte |
1,98 kg·m−3 (0 °C, 1013 hPa)[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
keiner bei Normaldruck (sublimiert)[2] | |||||||||
| Sublimationspunkt |
−78,5 °C[2] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit |
3,3 g·l−1 bei 0 °C, 1,7 g·l−1 bei 20 °C, jeweils bei 1013 hPa[3] | |||||||||
| Brechungsindex |
1,6630 (24 °C, Sättigungsdampfdruck)[4] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| MAK |
9100 mg·m−3[2] | |||||||||
| Treibhauspotential |
1 (per Definition) [6] | |||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 |
−393,5 kJ·mol−1[7] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Kohlenstoffdioxid, auch Kohlendioxid, ist eine chemische Verbindung aus Kohlenstoff und Sauerstoff mit der Summenformel CO2. In gelöster Form wird es umgangssprachlich oft – besonders im Zusammenhang mit kohlendioxidhaltigen Getränken – ungenau Kohlensäure genannt. Kohlenstoffdioxid ist ein unbrennbares, saures, farb- und geruchloses Gas, das sich gut in Wasser löst. Mit basischen Metalloxiden oder -hydroxiden bildet es zwei Arten von Salzen, die Carbonate und Hydrogencarbonate genannt werden.
Kohlenstoffdioxid, ein wichtiges Treibhausgas, ist ein natürlicher Bestandteil der Luft, wo es im Jahr 2013 in einer mittleren Konzentration von 0,040 Vol.-% (400 ppm) vorkommt.[8] Es entsteht sowohl bei der Verbrennung von kohlenstoffhaltigen Substanzen unter ausreichender Sauerstoffzufuhr als auch im Organismus von Lebewesen als Produkt der Zellatmung. Pflanzen, manche Bakterien und Archaeen wandeln Kohlenstoffdioxid durch Fixierung in Biomasse um. Bei der Photosynthese entsteht aus anorganischem Kohlenstoffdioxid und Wasser Glucose. Kohlenstoffdioxid ist ein wichtiger Bestandteil des globalen Kohlenstoffzyklus. Kohlenstoffdioxid kann toxisch wirken, jedoch reichen die Konzentrationen und Mengen in der Luft oder durch Limonadengenuss hierfür bei weitem nicht aus. Es besitzt ein breites technisches Anwendungsspektrum. In der chemischen Industrie wird es zur Gewinnung von Harnstoff eingesetzt. In fester Form als Trockeneis wird es als Kühlmittel eingesetzt, überkritisches Kohlenstoffdioxid dient als Löse- und Extraktionsmittel.
Bei einem hohen Ölpreis und günstigen Strompreisen zum Beispiel aus Windkraftanlagen könnte es sich zukünftig lohnen, für Prozesse der organischen Chemie den Kohlenstoff aus Kohlenstoffdioxid statt aus Öl oder Gas zu gewinnen.[9]
Geschichte
Kohlenstoffdioxid war eines der ersten Gase, das als solches im Unterschied zu Luft so bezeichnet wurde. Im 17. Jahrhundert beobachtete der flämische Chemiker Johan Baptista van Helmont, dass die Masse von Holzkohle bei der Verbrennung abnahm, da die Masse der verbleibenden Asche geringer war als die der eingesetzten Holzkohle. Seine Interpretation war, dass sich der Rest der Holzkohle in eine unsichtbare Substanz verwandelt hatte, die er Gas oder Spiritus sylvestre (Wilder Geist) nannte.[10]
Die Eigenschaften von Kohlenstoffdioxid wurden durch den schottischen Arzt Joseph Black gründlicher studiert. Er fand im Jahr 1754 heraus, dass beim Versetzen von Calciumcarbonat-Lösungen mit Säuren ein Gas freigesetzt wurde, das er fixed air (fixierte/festgesetzte Luft) nannte.[11] Er erkannte, dass dieses schwerer als Luft war und Verbrennungsvorgänge nicht unterstützte. Beim Einleiten dieses Gases in eine Lösung von Calciumhydroxid konnte er einen Niederschlag erzeugen. Mit diesem Phänomen zeigte er, dass Kohlenstoffdioxid im Atem von Säugetieren vorkommt und durch mikrobiologische Fermentation freigesetzt wird. Seine Arbeiten bewiesen, dass Gase an chemischen Reaktionen beteiligt sein können, und trugen zum Fall der Phlogistontheorie bei.[12]
Joseph Priestley gelang 1772 die erste Herstellung von Sodawasser, indem er Schwefelsäure in eine kalkhaltige Lösung leitete und das entstandene Kohlenstoffdioxid in einem Becher mit Wasser löste.[13] Im Jahr 1823 verflüssigten Humphry Davy und Michael Faraday Kohlenstoffdioxid durch Druckerhöhung.[14] Die erste Beschreibung von festem Kohlenstoffdioxid stammt von Charles Thilorier, der 1834 einen unter Druck stehenden Behälter mit flüssigem Kohlenstoffdioxid öffnete und feststellte, dass die spontane Verdampfung unter Abkühlung stattfindet, die zu festem CO2 führt.[15]
Vorkommen
Kohlenstoffdioxid kommt in der Atmosphäre, der Hydrosphäre, der Lithosphäre und der Biosphäre vor. Der Kohlenstoffaustausch zwischen diesen Erdsphären erfolgt zum großen Teil durch Kohlenstoffdioxid. In der Atmosphäre befinden sich circa 800 Gigatonnen (800 Milliarden Tonnen) Kohlenstoff in Form von Kohlenstoffdioxid. Die Hydrosphäre enthält circa 38.000 Gigatonnen Kohlenstoff in Form von physikalisch gelöstem Kohlenstoffdioxid sowie als gelöste Hydrogencarbonate- und Carbonate. Die Lithosphäre enthält den bei weitem größten Anteil chemisch gebundenen Kohlenstoffdioxids. Carbonatgesteine wie Calcit und Dolomit enthalten etwa 60.000.000 Gigatonnen Kohlenstoff.[16]
Vorkommen in der Atmosphäre


Kohlenstoffdioxid ist ein Spurengas der Erdatmosphäre, das 2013 die Schwelle von 400 ppm (parts per million, Teile pro Million) überschritten hat, wie die Messung der Nationalen Behörde für Ozean- und Atmosphärenforschung (NOAA) der Vereinigten Staaten auf dem Mauna Loa Vulkan ergab.[17][18]
Die Gesamtmasse an Kohlenstoffdioxid in der Atmosphäre beträgt circa 3000 Gigatonnen beziehungsweise etwa 800 Gt Kohlenstoff (das Verhältnis der Molmassen von CO2 und C ist 11/3). Die Konzentration variiert jahreszeitlich sowie lokal besonders in Bodennähe. In städtischen Regionen ist die Konzentration im Allgemeinen höher, in geschlossenen Räumen kann die Konzentration bis um das Zehnfache des Durchschnittswerts liegen.[19]
Kohlenstoffdioxid absorbiert einen Teil der Wärmestrahlung (Infrarotstrahlung), während der kurzwelligere Teil der Sonnenstrahlung nahezu ungehindert passieren kann. Ein absorbierender Körper emittiert auch entsprechend seiner Temperatur. Diese Eigenschaften macht Kohlenstoffdioxid zu einem sogenannten Treibhausgas. Nach Wasserdampf ist Kohlenstoffdioxid entsprechend seinem Mengenanteil das zweitwirksamste der Treibhausgase, wenngleich die spezifischen Wirksamkeiten von Methan und Ozon höher sind. Alle Treibhausgase zusammen erhöhen die mittlere Temperatur auf der Erdoberfläche durch den natürlichen Treibhauseffekt von circa −18 °C auf +15 °C. Kohlenstoffdioxid hat einen relativ großen Anteil am Gesamteffekt und ist somit für das lebensfreundliche Klima der Erde mitverantwortlich.[20]
Der Kohlenstoffdioxid-Anteil in der Erdatmosphäre war im Verlauf der Erdgeschichte beträchtlichen Schwankungen unterworfen, die verschiedene biologische, chemische und physikalische Ursachen haben. Vor 500 Millionen Jahren war die Kohlenstoffdioxid-Konzentration circa 20-fach höher als in der heutigen Zeit.[21] Der Wert sank kontinuierlich und betrug im Jura etwa das Vier- bis Fünffache des aktuellen Werts. Seitdem sank der Wert weiter. Seit wenigstens 650.000 Jahren lag der Anteil jedoch immer unterhalb von 280 ppm.[22] Die Kohlenstoffdioxid-Konzentration in den letzten 10.000 Jahren blieb relativ konstant bei 280 ppm. Die Bilanz des Kohlenstoffdioxidkreislaufes war somit in dieser Zeit ausgeglichen. Mit Beginn der Industrialisierung im 19. Jahrhundert stieg der Kohlenstoffdioxid-Anteil in der Atmosphäre. Die gegenwärtige Konzentration ist wahrscheinlich der höchste Wert seit 15 bis 20 Millionen Jahren.[23] Im Zeitraum von 1960 bis 2005 stieg der Kohlenstoffdioxid-Anteil im Mittel um 1,4 ppm pro Jahr.[24]

Die anthropogenen, das heißt vom Menschen verursachten, Kohlenstoffdioxid-Emissionen betragen jährlich circa 36,3 Gigatonnen[24] und sind nur ein kleiner Anteil des überwiegend aus natürlichen Quellen stammenden Kohlenstoffdioxids von jährlich etwa 550 Gigatonnen.[25] Da die natürlichen Kohlenstoffsenken jedoch gleich viel CO2 wieder aufnehmen, blieb die Kohlenstoffdioxid-Konzentration vor der Industrialisierung relativ konstant. Das zusätzliche Kohlenstoffdioxid wird etwa zur Hälfte von der Biosphäre und von den Ozeanen (dies hat deren Versauerung zur Folge) aufgenommen, so dass diese jetzt mehr Kohlenstoffdioxid aufnehmen als sie abgeben. Die andere Hälfte des ausgestoßenen Kohlenstoffdioxids verbleibt in der Atmosphäre und führt dort zu der messbaren Zunahme der Konzentration, was von Charles Keeling mit der nach ihm benannten Keeling-Kurve erstmals Anfang der 1960er Jahre gezeigt werden konnte.
Es ist allgemein anerkannt, dass es einen statistisch signifikanten anthropogenen Einfluss auf das Klima gibt, der hauptverantwortlich für die globale Erwärmung ist. Diese Erwärmung geht sehr wahrscheinlich zum größten Teil auf die Verstärkung des Treibhauseffektes durch den Ausstoß von Treibhausgasen zurück.[26] Das zusätzlich erzeugte Kohlenstoffdioxid hat einen Anteil von etwa 60 % an der Verstärkung des Treibhauseffektes.[27][28] Die Folgen der globalen Erwärmung sollen durch Klimaschutz gemindert werden. Tabellarische Zusammenstellungen der CO2-Emittenten sind in der Liste der größten Kohlenstoffdioxidemittenten und der Länderliste CO2-Emission pro Kopf zu finden.
Vorkommen in Ozeanen
Das Wasser der Ozeane enthält Kohlenstoffdioxid in gelöster Form sowie als Kohlensäure im Gleichgewicht mit Hydrogencarbonaten und Carbonaten. Die gelöste Menge ändert sich mit der Jahreszeit, da sie von der Temperatur und dem Salzgehalt des Wassers abhängt: Kaltes Wasser löst mehr Kohlenstoffdioxid. Da kaltes Wasser eine höhere Dichte aufweist, sinkt das kohlenstoffdioxidreiche Wasser in tiefere Schichten ab. Nur bei Drücken über 300 bar und Temperaturen über 120 °C (393 K) ist es umgekehrt, etwa in der Nähe von tiefen, geothermalen Schloten.[29] Daher sinkt die Aufnahmefähigkeit der Ozeane für Kohlenstoffdioxid mit steigender Temperatur.
In den Ozeanen ist etwa 50-mal mehr Kohlenstoff enthalten als in der Atmosphäre. Der Ozean wirkt als große Kohlenstoffdioxidsenke und nimmt circa ein Drittel der durch menschliche Aktivitäten freigesetzten Menge Kohlenstoffdioxid auf.[30] In den oberen Schichten der Ozeane wird es teilweise durch Photosynthese gebunden. Mit steigender Lösung von Kohlenstoffdioxid sinkt die Alkalinität des Salzwassers, und es wird befürchtet, dass sich dies negativ auf die Ausbildung von Muschelschalen auswirkt.[31] Andererseits gibt es Hinweise, dass eine erhöhte Kohlenstoffdioxid-Konzentration einige Spezies zu vermehrter Muschelschalenproduktion anregt.[32]
Vorkommen im Süßwasser
Durch spezielle geologische Bedingungen kann Süßwasser mit erheblichen Mengen Kohlenstoffdioxid beladen sein, etwa Wasser aus Mineralquellen oder in Seen auf erloschenen Vulkanen, sogenannten Maaren. In seltenen Fällen kommt es zu Naturkatastrophen mit Kohlenstoffdioxid. Eine dieser Katastrophen ereignete sich 1986 am Nyos-See in Kamerun.[33] Der See befindet sich in einem alten Vulkankrater im Oku-Vulkangebiet. Eine Magmakammer speist den See mit Kohlenstoffdioxid, dessen Wasser damit gesättigt ist. Wahrscheinlich ausgelöst durch einen Erdrutsch wurden 1986 große Mengen von Kohlenstoffdioxid aus dem See freigesetzt und töteten etwa 1700 Bewohner sowie 3500 Nutztiere umliegender Dörfer. Eine ähnliche Katastrophe ereignete sich 1984 am Manoun-See, dessen Wasser durch einen ähnlichen Mechanismus mit Kohlenstoffdioxid gesättigt wird. Bei dieser spontanen Kohlenstoffdioxidfreisetzung kamen 37 Menschen ums Leben. Auch der Kiwusee in Zentralafrika weist in seinem Tiefenwasser hohe Konzentrationen an gelösten Gasen auf. Es wird geschätzt, dass etwa 250 km3 Kohlenstoffdioxid im See gelöst sind.[34]
Extraterrestrisches Vorkommen
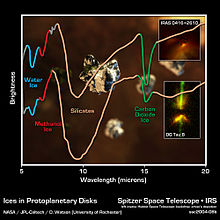
Die Atmosphäre der Venus besteht zu 96,5 % aus Kohlenstoffdioxid bei einem Druck von etwa 90 bar. Der wegen des hohen Kohlendioxid-Anteils starke Treibhauseffekt wird durch die Nähe zur Sonne verstärkt und führt zu einer Oberflächentemperatur von etwa 480 °C.[35] Kohlenstoffdioxid stellt mit einem Anteil von 95 % ebenfalls den Hauptteil der Mars-Atmosphäre.[36] An den Mars-Polen wird atmosphärisches Kohlenstoffdioxid teilweise als Trockeneis gebunden. Durch den niedrigen Atmosphärendruck von etwa sieben Millibar führt der Treibhauseffekt trotz des hohen Kohlenstoffdioxid-Anteils nur zu einer Erhöhung um etwa 5 °C. Die Atmosphären der äußeren Planeten und deren Trabanten enthalten Kohlenstoffdioxid, dessen Herkunft Einschlägen von Kometen wie Shoemaker-Levy 9 und kosmischem Staub zugeschrieben wird.[37][38] Mit den Instrumenten des Hubble-Weltraumteleskops fand die NASA auf extrasolaren Planeten wie HD 189733 b Kohlenstoffdioxid.[39]
Kohlenstoffdioxid wird sowohl im interstellaren Raum als auch in protoplanetarischen Scheiben um junge Sterne gefunden.[40] Die Bildung erfolgt durch Oberflächenreaktionen von Kohlenstoffmonoxid und Sauerstoff auf Wassereispartikeln bei Temperaturen um –123 °C (150 K). Durch Verdampfung des Eises wird das Kohlenstoffdioxid freigesetzt.[41] Im freien interstellaren Raum ist die Konzentration relativ gering, da durch Reaktion mit atomarem und molekularem Wasserstoff Wasser und Kohlenstoffmonoxid gebildet wird.[42]
Gewinnung und Darstellung
Kohlenstoffdioxid entsteht bei der Verbrennung kohlenstoffhaltiger Brennstoffe, insbesondere der fossilen Energieträger. Dabei fallen weltweit etwa 36 Milliarden Tonnen Kohlenstoffdioxid pro Jahr an. Da kein wirtschaftliches Verfahren zur Kohlenstoffdioxidabtrennung zur Verfügung steht, entweicht diese Menge in die Atmosphäre.[43]
Kohlenstoffdioxid entsteht bei der Reaktion von Kohlenstoff mit Sauerstoff:
Technisch fällt Kohlenstoffdioxid beim Verbrennen von Koks mit überschüssiger Luft an. Bei der Kohlevergasung und der Dampfreformierung von Erdgas fällt Kohlenstoffdioxid unter anderem als Produkt der Wassergas-Shift-Reaktion in der Synthesegasherstellung an. Für den Einsatz in der Ammoniaksynthese und bei der Methanolherstellung wird das Synthesegas zum Beispiel im Rectisolverfahren gewaschen, Kohlenstoffdioxid fällt dadurch in großen Mengen in sehr reiner Form an.[45][46] Als Nebenprodukt fällt Kohlenstoffdioxid beim Kalkbrennen an. Durch anschließende Reinigung über Bildung von Kaliumcarbonat zu Hydrogencarbonat und anschließendes Freisetzen durch Erhitzen werden pro Jahr etwa 530 Millionen Tonnen gewonnen.
Im Labor kann Kohlenstoffdioxid aus Calciumcarbonat und Salzsäure freigesetzt werden, zum Beispiel in einem Kippschen Apparat. Das Gerät fand früher in Laboratorien Verwendung. Die Methode wird kaum noch genutzt, da Kohlenstoffdioxid in Gasflaschen oder als Trockeneis erhältlich ist.[47]
Eigenschaften

Physikalische Eigenschaften
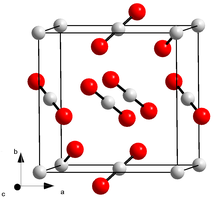
Kohlenstoffdioxid liegt bei Normaldruck unter −78,5 °C als Feststoff, dem Trockeneis vor. Wird dieses erhitzt, schmilzt es nicht, sondern sublimiert, geht also direkt in den gasförmigen Aggregatzustand über. Festes Kohlenstoffdioxid kristallisiert im kubischen Kristallsystem in der Raumgruppe Pa3 mit dem Gitterparameter a = 562,4 pm.[48]
Die kritische Temperatur beträgt 31,0 °C, der kritische Druck 73,8 bar.[49] Unterhalb der kritischen Temperatur kann Kohlenstoffdioxid durch Drucksteigerung zu einer farblosen Flüssigkeit verdichtet werden.[50] Bei Raumtemperatur ist dazu ein Druck von circa 60 bar erforderlich.
Kohlenstoffdioxid absorbiert Teile des elektromagnetischen Spektrums unter anderem im Bereich der Infrarotstrahlung und wird dabei zu Molekülschwingungen angeregt. Auf dieser Eigenschaft beruht seine Wirkung als Treibhausgas.
Die Löslichkeit in Wasser ist vergleichsweise hoch. Bei Raumtemperatur unter Normaldruck liegt die Sättigung bei 1700 mg/l, während sie bei Sauerstoff bereits bei 9 mg/l und bei Stickstoff bei 20 mg/l erreicht wird. Unter Standardbedingungen ist die Dichte von Kohlenstoffdioxid 1,98 kg/m3.[51]
Molekulare Eigenschaften

Das Kohlenstoffdioxidmolekül ist linear, alle drei Atome liegen auf einer geraden Linie. Der Kohlenstoff ist an die beiden Sauerstoffatome mit Doppelbindungen gebunden, wobei beide Sauerstoffatome zwei freie Elektronenpaare aufweisen. Der Kohlenstoff-Sauerstoff-Abstand beträgt 116,32 pm.[50] Die Kohlenstoff-Sauerstoff-Bindungen sind durch die unterschiedlichen Elektronegativitäten von Kohlenstoff und Sauerstoff polarisiert, die elektrischen Dipolmomente heben sich aber durch die Molekülsymmetrie nach außen hin gegenseitig auf, so dass das Molekül kein elektrisches Dipolmoment aufweist.
Chemische Eigenschaften
In Wasser gelöstes Kohlenstoffdioxid bildet Kohlensäure, H2CO3, wobei mehr als 99 % des Kohlenstoffdioxids nur physikalisch gelöst sind. Die Kohlensäure als solche beziehungsweise das gelöste Kohlenstoffdioxid liegt in einem Gleichgewicht mit ihren Dissoziationsprodukten (Spezies) Hydrogencarbonat (Bicarbonat, HCO3−) und Carbonat (CO32−) vor, die in einem vom pH-Wert abhängigen Mengenverhältnis zueinander stehen. In Wasser liegt dieses Gleichgewicht überwiegend auf der Seite des Kohlenstoffdioxids und nur im geringen Umfang bilden sich Hydrogencarbonationen. Werden die bei der Dissoziation gebildeten Oxoniumionen (H3O+) durch Zugabe einer Lauge mit Hydroxidionen (OH−) abgefangen, so verschiebt sich das Mengenverhältnis zu Gunsten von Carbonat.
Unedle Metalle wie Magnesium, die als starke Reduktionsmittel fungieren, reagieren mit Kohlenstoffdioxid unter Bildung von Kohlenstoff und Metalloxiden gemäß:[52]
Auf Grund der positiven Partialladung am Kohlenstoff reagiert Kohlenstoffdioxid als Elektrophil in der Carboxylierung von Kohlenstoffnukleophilen wie Metall-Alkinyliden oder Alkylmagnesiumverbindungen unter Ausbildung einer Kohlenstoff-Kohlenstoff-Bindung. Mit Phenolaten reagiert Kohlenstoffdioxid zu Phenolcarbonsäuren.
Verwendung
Industriell wird Kohlenstoffdioxid in vielfältiger Weise verwendet. Es ist preiswert, nicht entflammbar und wird physikalisch als komprimiertes Gas, in flüssiger Form, fest als Trockeneis oder in überkritischer Phase benutzt. Die chemische Industrie nutzt Kohlenstoffdioxid als Rohmaterial für chemische Synthesen.
Gasförmiges Kohlenstoffdioxid
In Getränken enthaltenes Kohlenstoffdioxid stimuliert beim Trinken die Geschmackssinneszellen, was einen Erfrischungseffekt zur Folge hat. Bei Getränken wie Bier oder Sekt entsteht es durch Gärung, bei anderen wie Limonade oder Sodawasser wird es künstlich zugesetzt oder es wird kohlenstoffdioxidhaltiges, natürliches Mineralwasser verwendet. Bei der Herstellung wird Kohlenstoffdioxid unter hohem Druck in das Getränk gepumpt, wobei es zu etwa 0,2 % mit Wasser zu Kohlensäure reagiert, während sich der größte Teil als Gas im Wasser löst. Als Lebensmittelzusatzstoff trägt es die Bezeichnung E 290.[53] Im Privathaushalt wird mit Sodabereitern Kohlendioxid aus Druckpatronen durch das anzureichernde Getränk geleitet. Ähnliche Druckpatronen dienen im Modellbau als Energiespeicher zum Betrieb von Kohlendioxidmotoren.
Kohlenstoffdioxid kommt wegen seiner sauerstoffverdrängenden Eigenschaften zu Feuerlöschzwecken, vor allem in Handfeuerlöschern und automatischen Löschanlagen wie Kohlenstoffdioxid-Löscher als Löschmittel zum Einsatz. CO2-Löschanlagen fluten zum Schutz von Silos oder Lagerhallen für brennbare Flüssigkeiten den kompletten Raum mit Kohlenstoffdioxid. Dadurch kommt es zu Unfällen, teilweise mit Todesfolge durch Ersticken.[54] Eine Studie der US-amerikanischen Umweltbehörde EPA identifizierte 51 Unfälle zwischen 1975 und 1997 mit 72 Todesfällen und 145 Verletzten.[55]

Als Kältemittel kommt Kohlenstoffdioxid unter der Bezeichnung R744 in Fahrzeug- und stationären Klimaanlagen, bei industrieller Kältetechnik, Supermarkt- und Transportkühlung sowie in Getränkeautomaten zum Einsatz.[56] Es hat eine große volumetrische Kälteleistung und damit eine höhere Effizienz bei gegebenen Volumen. Kohlenstoffdioxid weist eine hohe Umweltverträglichkeit auf, da das Treibhauspotenzial nur ein Bruchteil der heute verwendeten Kältemittel beträgt. Es besitzt kein Ozonabbau-Potenzial. Kohlenstoffdioxid wird sowohl in Wärmekreisläufen als auch in Warmwasserpumpen und Fahrzeugheizungen genutzt.[57] In gasgekühlten Kernreaktoren des Typs AGR wird Kohlenstoffdioxid als Kühlmittel eingesetzt.
Kohlenstoffdioxid wird als Schutzgas in der Schweißtechnik eingesetzt, entweder in reiner Form oder als Zusatz zu Argon oder Helium. Bei hohen Temperaturen ist es thermodynamisch instabil, daher wird es nicht als Inertgas, sondern als Aktivgas bezeichnet.[58]
Backhefe entwickelt durch die Vergärung von Zucker Kohlenstoffdioxid und dient als Triebmittel bei der Herstellung von Hefeteig. Backpulver, eine Mischung aus Natriumhydrogencarbonat und einem sauren Salz, setzt beim Erhitzen Kohlenstoffdioxid frei und wird ebenfalls als Triebmittel verwendet.[59]
Beim Kohlendioxidlaser durchströmt Lasergas, ein Gemisch aus Stickstoff, Helium und Kohlenstoffdioxid, kontinuierlich das Entladungsrohr. Er zählt neben den Festkörperlasern zu den leistungsstärksten industriell eingesetzten Gaslasern mit Leistungen zwischen 10 Watt und 20 Kilowatt. Der Wirkungsgrad liegt bei etwa 10 bis 20 %.[60]
Flüssiges Kohlenstoffdioxid
In flüssiger Form wird Kohlenstoffdioxid in Druckgasflaschen gehandelt. Dabei gibt es zwei Typen: Steigrohrflaschen zur Flüssigentnahme und Flaschen ohne Steigrohr zur Entnahme gasförmigen Kohlenstoffdioxids.[61] Beide müssen zur Entnahme senkrecht stehen. Die Steigrohrflasche wird grundsätzlich ohne, die andere mit Druckminderventil betrieben. Solange sich noch flüssiges Kohlenstoffdioxid in der Druckflasche befindet, ist der Innendruck lediglich von der Temperatur abhängig. Eine Messung des Füllstandes ist deshalb bei beiden Flaschentypen ausschließlich über Wägen möglich. Die Entnahmegeschwindigkeit ist dadurch begrenzt, dass durch Wärmeaufnahme aus der Umgebung erst wieder flüssiges Kohlenstoffdioxid in der Flasche verdampfen muss, um den der Temperatur entsprechenden Druck wieder aufzubauen.
Festes Kohlenstoffdioxid
Bei der Sublimation von Trockeneis entsteht ein weißer Nebel aus dem kalten Kohlenstoffdioxid-Luft-Gemisch und kondensierender Luftfeuchtigkeit, der früher als Effekt in der Bühnentechnik Einsatz fand. Heute gibt es zum Beispiel Nebelkühl-Vorsätze für normale Verdampfer-Nebelmaschinen, die mit flüssigem Kohlenstoffdioxid betrieben werden.[62]
In zunehmendem Maße wird Kohlenstoffdioxid in Verbindung mit einem automatisierbaren Strahlverfahren verwendet, um hochreine Oberflächen zu erzeugen. Mit seiner Kombination aus mechanischen, thermischen und chemischen Eigenschaften kann beispielsweise Kohlenstoffdioxid-Schnee verschiedene Arten von Oberflächen-Verunreinigungen rückstandsfrei lösen und abtragen.[63]
Bei der Weinherstellung wird Trockeneis als Kühlmittel verwendet, um frisch gepflückte Trauben ohne Wasserverdünnung zu kühlen und so eine spontane Fermentation zu vermeiden. Die Weinbauern in Beaujolais benutzen die Kohlensäuremaischung zur Erzeugung des Beaujolais Primeur.[64]
Überkritisches Kohlenstoffdioxid
Überkritisches Kohlenstoffdioxid besitzt eine hohe Löslichkeit für unpolare Stoffe und kann giftige organische Lösemittel ersetzen. Es wird als Extraktionsmittel, zum Beispiel zur Extraktion von Naturstoffen wie Koffein bei der Herstellung von koffeinfreiem Kaffee durch Entkoffeinierung, und als Lösemittel zum Reinigen und Entfetten, zum Beispiel von Wafern in der Halbleiterindustrie und von Textilien in der Chemischen Reinigung, verwendet.[65][66] Überkritisches Kohlenstoffdioxid wird als Reaktionsmedium für die Feinchemikalienherstellung zum Beispiel für die Herstellung von Aromastoffen verwendet, da isolierte Enzyme hierin vielfach aktiv bleiben und keine Lösungsmittelrückstände im Gegensatz zu organischen Lösungsmitteln in den Produkten verbleiben.
In der tertiären Ölförderung wird überkritisches Kohlenstoffdioxid zur Flutung von Öllagerstätten verwendet, um Öl aus größeren Tiefen an die Oberfläche zu spülen.[67]
Chemische Verwendung
In der chemischen Industrie wird Kohlenstoffdioxid durch Umsatz mit Ammoniak vor allem für die Herstellung von Harnstoff verwendet. Im ersten Schritt reagieren Ammoniak und Kohlenstoffdioxid zu Ammoniumcarbamat, welches im zweiten Schritt zu Harnstoff und Wasser weiterreagiert.[68]
Durch Reduktion mit Wasserstoff wird Formamid erhalten. Durch Reaktion mit Aminen wie Dimethylamin wird Dimethylformamid erhalten.[69]
Durch Umsetzung von Kohlenstoffdioxid mit Natrium-Phenolat wird mit der Kolbe-Schmitt-Reaktion Salicylsäure gewonnen.[70]
Durch Umsatz mit Ethylenoxid wird Ethylencarbonat hergestellt. Dieses wird im OMEGA-Prozess mit Wasser hochselektiv zu Monoethylenglykol umgesetzt. Durch Reaktion mit Toluol wird Toluylsäure gewonnen.
Präparativ führt der Einsatz von Kohlenstoffdioxid in der Grignard-Reaktion zu aliphatischen Carbonsäuren.
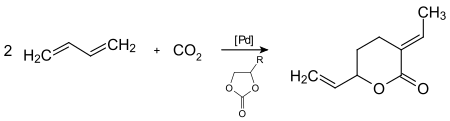
Die Telomerisation von Kohlenstoffdioxid mit zwei Molekülen 1,3-Butadien unter homogener Palladium-Katalyse führt zu Feinchemikalien wie Lactonen unter milden Reaktionsbedingungen.[68]
Im Solvay-Verfahren wird aus Kohlenstoffdioxid Soda (Natriumcarbonat) hergestellt. Manche Metallcarbonate wie Bleicarbonat, die zum Beispiel durch Umsatz der Metallhydroxide mit Kohlenstoffdioxid erhalten werden, haben eine Bedeutung als Pigment.
Kohlenstoffdioxidrecycling
Neben der Kohlendioxid-Abscheidung und -Lagerung gehen die Forschungen in die Richtung, das bei der Verbrennung von fossilen Energieträgern anfallende Kohlenstoffdioxid in verwertbare Verbindungen und nach Möglichkeit wieder in Energieträger umzuwandeln. So lassen sich bereits über Reduktion Verbindungen wie Methanol[71] und Ameisensäure herstellen[72].
Ebenso ist die Synthese von Harnstoff möglich. Ein französisches Forscherteam untersucht die Möglichkeiten der organokatalytischen Umwandlung zu Formamid beziehungsweise dessen Derivaten.[73][74] Die notwendige Zuführung von Prozessenergie führt dazu, dass die Verfahren nicht zur wirtschaftlichen Herstellung von Energieträgern geeignet sind. Wissenschaftler der RWTH Aachen entwickelten ein homogen-katalytisches Verfahren zur Herstellung von Methanol aus Kohlenstoffdioxid und Wasserstoff unter Druck mit einem speziellen Ruthenium-Phosphin-Komplex, bei dem Katalysator und Edukte in Lösung vorliegen.[75] Gleichfalls wurde ein kontinuierliches Verfahren zur Herstellung von Ameisensäure mit einem metallorganischen Rutheniumkomplex entwickelt, bei dem Kohlenstoffdioxid die Doppelrolle sowohl als Reaktant als auch in überkritischer Form als extraktive Phase für die gebildete Ameisensäure hat.[76] In einer anderen Variante, die von einer spanischen Forschergruppe entwickelt wurde, lässt sich Kohlenstoffdioxid über eine Iridium-katalysierte Hydrosilylierung umsetzen und in Form eines Silyl-Formiats abfangen, aus dem sich Ameisensäure leicht abtrennen lässt. Diese Reaktion, die bereits im Gramm-Maßstab realisiert werden konnte, läuft bei sehr milden Reaktionsbedingungen, ist sehr selektiv und hat einen hohen Umsatz.[77]
Im „Innovationszentrum Kohle“ erforschen RWE und die Brain AG, wie Mikroorganismen CO2 umwandeln.[78]
Sonstige Verwendung
Kohlendioxid wurde routinemäßig als Anästhetikum bei Menschen eingesetzt[79] und als sehr zufriedenstellend bewertet. Diese Methode wird mittlerweile nicht mehr in der klassischen Anästhesie bei Menschen genutzt, da wirksamere, inhalierbare Anästhetika eingeführt wurden.
Kohlenstoffdioxid ist im Rahmen der Tiereuthanasie weit verbreitet.[80] In Kohlenstoffdioxid-Anlagen werden in jüngster Zeit Schweine vor der Schlachtung betäubt. Dazu werden sie in Gruppen in einem Paternosteraufzug in eine Grube hinab gelassen, die mindestens 90 % Kohlenstoffdioxid enthält, und verlieren dabei das Bewusstsein.[81] Der Einsatz in hohen Konzentrationen für die Betäubung von Schlachtschweinen wird immer noch sehr kontrovers diskutiert. Aufgrund des Fehlens von besseren, mechanisch wirksamen Alternativen wird diese Methode immer noch toleriert. Mit wenig Einschränkungen wird Kohlenstoffdioxid für die Euthanasie von kleinen Labortieren empfohlen.[80]
Kohlenstoffdioxid wird als Abführmitteln in Zäpfchen verwendet. Durch die Reaktion von Natriumdihydrogenphosphat und Natriumhydrogencarbonat während der Auflösung des Zäpfchens wird Kohlenstoffdioxid freigesetzt und dehnt den Darm, was wiederum den Stuhlreflex auslöst.[82]
Kohlenstoffdioxid wird als Dünger in Gewächshäusern eingesetzt. Grund ist der durch den photosynthetischen Verbrauch entstehende Kohlenstoffdioxid-Mangel bei ungenügendem Nachschub an Frischluft, besonders im Winter bei geschlossener Lüftung. Dabei wird das Kohlenstoffdioxid entweder direkt als reines Gas oder als Verbrennungsprodukt aus Propan oder Erdgas eingebracht. Dadurch wird eine Kopplung von Düngung und Heizung erreicht. Die mögliche Ertragsteigerung ist abhängig davon, wie stark der Mangel an Kohlenstoffdioxid ist und wie stark das Lichtangebot für die Pflanzen ist.[83] Kohlenstoffdioxid wird in der Aquaristik als Dünger für Wasserpflanzen eingesetzt (CO2-Diffusor). Durch Zufuhr von organischer Substanz kann der Kohlenstoffdioxid-Gehalt im Wasser durch Veratmung auf Kosten des Sauerstoff-Gehalts erhöht werden.[84]
Eingesetzt wird das Gas bei dem Fang blutsaugender Insekten und Vektoren, die das im Atem vorkommende Kohlenstoffdioxid in ihrer Wirtsfindung verwenden, wie etwa Stechmücken. Es wird dabei aus Trockeneis, aus Gasflaschen oder aus der Verbrennung von Propan oder Butan freigesetzt und lockt die Insekten in die Nähe der Einsaugöffnung spezieller Fallen.[85]
Physiologische Wirkungen und Gefahren

Die Schadwirkung auf Tier und Mensch beruht nicht nur auf der Verdrängung des Sauerstoffes in der Luft. Die DIN EN 13779 teilt die Raumluft je nach Kohlenstoffdioxid-Konzentration in vier Qualitätsstufen ein. Bei Werten unter 800 ppm gilt die Raumluftqualität als gut, Werte zwischen 800 und 1000 ppm (0,08 bis 0,14 Vol.-%) gelten als mittel, Werte von 1000 bis 1400 ppm als mäßige Qualität. Bei Werten über 1400 ppm gilt die Raumluftqualität als niedrig.[86] Zum Vergleich: Im globalen Mittel liegt der CO2-Anteil der Luft bei etwa 390 ppm Volumenanteil, er schwankt aber regional, tageszeitabhängig und jahreszeitabhängig, stark. Unterhalb der Maximalen Immissions-Konzentration (MIK) von 3000 ppm (0,3 %) bestehen keine Gesundheitsbedenken bei dauerhafter Einwirkung. Die Maximale Arbeitsplatz-Konzentration für eine tägliche Exposition von acht Stunden pro Tag liegt bei 0,5 %.[87] Bei einer Konzentration von 1,5 % nimmt das Atemzeitvolumen um mehr als 40 % zu.
Im Blut gelöstes Kohlenstoffdioxid aktiviert in physiologischer und leicht gesteigerter Konzentration das Atemzentrum des Gehirns.
In deutlich höherer Konzentration führt es zur Verminderung oder Aufhebung des reflektorischen Atemanreizes, zunächst zur Atemdepression und schließlich zum Atemstillstand.[88] Ab etwa 5 % Kohlenstoffdioxid in der eingeatmeten Luft treten Kopfschmerzen und Schwindel auf, bei höheren Konzentrationen beschleunigter Herzschlag (Tachykardie), Blutdruckanstieg, Atemnot und Bewusstlosigkeit, die so genannte Kohlenstoffdioxid-Narkose. Kohlenstoffdioxid-Konzentrationen von 8 % führen innerhalb von 30 bis 60 Minuten zum Tod.[89][90]
Durch hohe Kohlenstoffdioxidkonzentrationen kommt es in Weinkellern, Futtersilos, Brunnen und Jauchegruben immer wieder zu Unfällen.[51] Durch Gärprozesse entstehen dort beträchtliche Mengen an Kohlenstoffdioxid, bei der Vergärung von einem Liter Most zum Beispiel etwa 50 Liter Gärgas. Oft fallen mehrere Personen einer Gärgasvergiftung zum Opfer, weil die Helfer beim Rettungsversuch selbst Kohlenstoffdioxid einatmen und bewusstlos werden. Die Rettung eines Verunglückten aus Kohlenstoffdioxid-verdächtigen Situationen ist nur durch professionelle Einsatzkräfte mit umluftunabhängigem Atemschutz möglich.[91]
Wenn nicht für ausreichende Entlüftung gesorgt ist, bilden sich durch natürliche Kohlenstoffdioxid-Quellen in Höhlen und in Bergwerksstollen mitunter hohe Konzentrationen des Gases. Diese befinden sich dann in Bodennähe, so dass vor allem kleinere Tiere ersticken können. So weist zum Beispiel die Hundsgrotte in Italien eine Kohlenstoffdioxid-Konzentration von circa 70 % auf.[92]
Die Kohlenstoffdioxidkonzentration im Blut beeinflusst dessen pH-Wert und hat damit eine indirekte Wirkung auf den Sauerstoffhaushalt. Das Kohlensäure-Bikarbonat-System, ein Kohlensäure-Hydrogencarbonat-Puffer, stellt etwa 50 % der Gesamtpufferkapazität des Blutes dar, der durch das Enzym Carboanhydratase katalysiert wird.[93]
Bei niedrigerem pH-Wert verringert sich seine Sauerstoff-Bindungskapazität. Bei gleichem Sauerstoff-Gehalt der Luft transportiert Hämoglobin weniger Sauerstoff. Der Bohr-Effekt und der Haldane-Effekt beschreiben diesen Sachverhalt.[94] Eine hohe Kohlenstoffdioxid-Konzentration ist für Pflanzen schädlich. Als Indikator-Pflanze dient zum Beispiel Mais, der nach einer sechstägigen Expositionsdauer von 10.000 ppm Kohlenstoffdioxid Streifen auf seinen Blättern zeigt.[95]
Ökologische Bedeutung
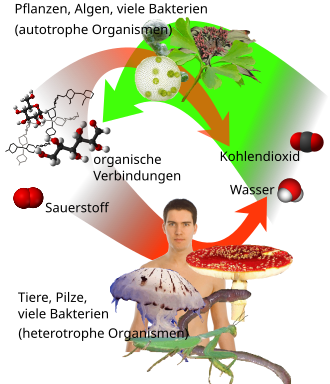
Pflanzen und photosynthesefähige Bakterien nehmen Kohlenstoffdioxid aus der Atmosphäre auf und wandeln es durch Photosynthese unter Einwirkung von Licht und Aufnahme von Wasser in Kohlenhydrate wie Glucose um. Dieser Prozess setzt gleichzeitig Sauerstoff aus der Dekomposition von Wasser frei. Die entstehenden Kohlenhydrate dienen als Energieträger und Baustoff für alle anderen biochemischen Substanzen wie Polysaccharide, Nukleinsäuren und Proteine. Kohlenstoffdioxid stellt damit den Rohstoff für die Bildung aller Biomasse in der Primärproduktion der Ökosysteme.[96]
Der Abbau von Biomasse durch aerobe Atmung ist, in Umkehrung zum Prozess der Photosynthese, wieder mit der Bildung von Kohlenstoffdioxid und dem Verbrauch von Sauerstoff verbunden.[97] Alle Organismen eines Ökosystems atmen fortwährend, während die Photosynthese an die Verfügbarkeit von Licht gebunden ist. Dieses führt zur zyklischen Kohlenstoffdioxid Zu- und Abnahme im täglichen und jahreszeitlichen Rhythmus in Abhängigkeit von den unterschiedlichen Lichtintensitäten.
In Gewässern schwankt die Kohlenstoffdioxid-Konzentration ebenfalls entsprechend den genannten Tages- und Jahreszeit-Rhythmen. Kohlenstoffdioxid steht mit den anderen gelösten Kohlensäure-Spezies in einem chemischen Gleichgewicht, welches den im Wasser herrschenden pH-Wert wesentlich bestimmt. Vom pH-Wert hängen wiederum die chemischen Gleichgewichtslagen der Dissoziationen von Ammonium/Ammoniak, Nitrit/Salpetrige Säure, Sulfid/Schwefelwasserstoff und anderen Säure-Basen-Paaren ab, die sich durch die Toxizität für die Organismen im Gewässer bemerkbar machen.[98]
Ist in einem Gewässer der Vorrat an Kohlenstoffdioxid durch Photosynthese erschöpft, was sich durch einen pH-Wert nahe 8,3 bemerkbar macht, sind manche Arten von Algen und Wasserpflanzen fähig, aus dem gelösten Hydrogencarbonat das benötigte Kohlenstoffdioxid zu gewinnen, wobei sie Hydroxidionen abgeben, sodass der pH-Wert immer alkalischer wird. In nährstoffreichen Gewässern wie Karpfenteichen kann der pH-Wert dann bis auf 12 steigen, mit den entsprechenden gesundheitlichen Folgen für die Fische, zum Beispiel Kiemennekrose der Karpfen.[99]
Wissenschaftlerinnen und Wissenschaftler des Biodiversität und Klima Forschungszentrums haben 2012 erstmals in einer gemeinsamen Studie mit anderen Institutionen berechnet, dass kryptogame Schichten aus Flechten, Algen und Moose neben Stickstoff jährlich rund 14 Milliarden Tonnen Kohlenstoffdioxid binden. Sie binden so viel Kohlenstoffdioxid, wie pro Jahr durch Waldbrände und die Verbrennung von Biomasse weltweit freigesetzt wird. Mit Hilfe der kryptogamen Schichten den Klimawandel zu bekämpfen ist jedoch nicht möglich, denn der flächige Bewuchs speichert das Treibhausgas Kohlenstoffdioxid nur über wenige Jahre hinweg.[100][101]
Eine Bedeutung hat die Speicherung und Freisetzung von Kohlenstoffdioxid in Böden. Wie stark die Freisetzung aus organischem Bodenkohlenstoff von den jeweiligen Umweltbedingungen und anderen Faktoren beeinflusst wird, ist derzeit weitgehend unbekannt. Die Freisetzung wird aber durch Erwärmung beschleunigt, was in neueren Studien gezeigt werden konnte, und könnte Auswirkungen auf das Klima haben.[102]
Nachweis und quantitative Bestimmung
Ein einfacher Nachweis von Kohlenstoffdioxid gelingt mit einer wässrigen Calciumhydroxidlösung, der so genannten Kalkwasserprobe. Dazu wird das zu untersuchende Gas in die Lösung eingeleitet. Enthält das Gas Kohlenstoffdioxid, reagiert dieses mit Calciumhydroxid zu Wasser und Calciumcarbonat (Kalk), das als weißlicher Feststoff ausfällt und die Lösung trübt.
Mit Barytwasser, einer wässrigen Bariumhydroxidlösung, ist der Nachweis empfindlicher, da Bariumcarbonat schwerer löslich ist als Calciumcarbonat.
In wässriger Lösung wird Kohlenstoffdioxid durch Titration mit 0,1 N Natronlauge bis zum pH-Wert von 8,3, dem Farbumschlag des Indikators Phenolphthalein, bestimmt. Die Messung des Säurebindungsvermögens (SBV), des pH-Wertes und der elektrischen Leitfähigkeit oder der Ionenstärke ermöglicht die Berechnung des Kohlenstoffdioxidgehalts aus diesen Parametern nach dem Dissoziationsgleichgewicht der Kohlensäure. Die Severinghaus-Elektrode, eine pH-Elektrode mit einer Pufferlösung aus Natriumhydrogencarbonat, bestimmt über die Messung der pH-Wert-Änderung die Kohlenstoffdioxid-Konzentration einer Lösung.[103]
Kohlenstoffdioxid kann mittels Infrarot- oder Ramanspektroskopie nachgewiesen werden, wobei die asymmetrischen Streckschwingungen sowie Kippschwingungen infrarotaktiv sind, während die symmetrische Streckschwingung bei einer Wellenzahl von 1480 cm−1 Raman-aktiv ist.[104] Das dazu verwendete Messgerät wird nichtdispersiver Infrarotsensor genannt.
Literatur
- Pörtner: Auswirkungen von CO2-Eintrag und Temperaturerhöhung auf die marine Biosphäre (PDF; 1,3 MB, 85 S.)
- J. Soentgen, A. Reller: CO2 – Lebenselixier und Klimakiller, oekom verlag 2009, ISBN 978-3-86581-118-9.
- J. N. Butler: Carbon Dioxide Equilibria and Their Applications, 272 Seiten, Verlag Lewis Publ. (1991) ISBN 0-87371-624-8, ISBN 978-0-87371-624-6.
- M. M. Halmann, M. Steinberg: Greenhouse Gas Carbon Dioxide Mitigation: Science and Technology, 568 Seiten, Verlag Crc Pr Inc (1998), ISBN 1-56670-284-4, ISBN 978-1-56670-284-3.
- M. M. Halmann: Chemical Fixation of Carbon Dioxide Methods Recycling: Methods of Recycling CO2 into Useful Products, 192 Seiten, Verlag: CRC Press Inc (1993), ISBN 0-8493-4428-X, ISBN 978-0-8493-4428-2.
Weblinks
- Umweltbundesamt – Deutsche Emissionshandelsstelle (DEHSt)
- Carbon Dioxide Information Analysis Center des U.S. Department of Energy
- Carbon Monitoring for Action (CARMA) – Datenbank mit Informationen zu den Kohlenstoffdioxidemissionen von über 50.000 Kraftwerken und 4.000 Energieunternehmen weltweit
Einzelnachweise
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online – Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c d e f g Eintrag zu Kohlenstoffdioxid in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Carbon Dioxide Solubility in Water ( vom 27. März 2010 im Internet Archive)
- ↑ “Index of Refraction of Inorganic Liquids”, in CRC Handbook of Chemistry and Physics, 90th Edition (Internet Version 2010), David R. Lide, ed., CRC Press/Taylor and Francis, Boca Raton, FL, S. 4-140.
- ↑ a b Datenblatt Carbon dioxide bei Sigma-Aldrich (PDF).
- ↑ United Nations Framework Convention on Climate Change: Global Warming Potentials
- ↑ Eintrag zu Kohlenstoffdioxid. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD
- ↑ R. F. Keeling u. a. : Atmospheric CO2 concentrations (ppm) derived from in situ air measurements at Mauna Loa, Observatory, Hawaii: Latitude 19.5 N, longitude 155.6 W, elevation 3397m. In: Scripps CO2 Program, Scripps Institution of Oceanography (SIO), University of California, La Jolla (2011).
- ↑ Alexis Bazzanella, Dennis Krämer, Martina Peters: CO2 als Rohstoff. In: Nachrichten aus der Chemie. 58, 2010, S. 1226–1230, doi:10.1002/nadc.201075752.
- ↑ William Emerson Brock, B. Kleidt, H. Voelker: Viewegs Geschichte der Chemie, Springer-Verlag, 488 Seiten, ISBN 3-540-67033-5, S. 35
- ↑ William Emerson Brock, B. Kleidt, H. Voelker: Viewegs Geschichte der Chemie, Springer-Verlag, 488 Seiten, ISBN 3-540-67033-5, S. 50
- ↑ William Emerson Brock, B. Kleidt, H. Voelker: Viewegs Geschichte der Chemie, Springer-Verlag, 488 Seiten, ISBN 3-540-67033-5, S. 72
- ↑ Joseph Priestley (1733-1804) - Experiments and Observations on Different Kinds of Air. Abgerufen am 21. Dezember 2013.
- ↑ Humphry Davy: On the Applicatin of Liquids Formed by the Condensation of Gases as Mechanical Agents. In: Philosophical Transactions of the Royal Society of London, 113 (1823): S. 199-205 doi:10.1098/rstl.1823.0020
- ↑ Duane H. D. Roller, M. Thilorier: Thilorier and the First Solidification of a "Permanent" Gas (1835). In: Isis. 43, 1952, S. 109, doi:10.1086/349402.
- ↑ Martin Kappas: Klimatologie, Spektrum Akademischer Verlag, 2009, Heidelberg, 356 Seiten, ISBN 978-3-8274-1827-2
- ↑ J. Ewald: Carbon Dioxide at NOAA’s Mauna Loa Observatory reaches new milestone: Tops 400 ppm. In: NOAA Research, 10 May 2013
- ↑ 400 Teil pro Million CO2-Dichte in Atmosphäre so hoch wie nie. In: Rheinische Post. Abgerufen am 11. Mai 2013.
- ↑ Innenraumluftqualität: Kohlendioxid (CO2), Temperatur und Luftfeuchte in Schulklassenräumen. In: Niedersächsisches Ministerium für Umwelt, Energie und Klimaschutz. Abgerufen am 19. Mai 2013.
- ↑ Karsten Schwanke, Nadja Podbregar, Dieter Lohmann, Harald Frater: Naturkatastrophen. Wirbelstürme, Beben, Vulkanausbrüche – entfesselte Gewalten und ihre Folgen, w2009, Springer Verlag, Berlin/Heidelberg, S. 286, ISBN 978-3-540-88684-6
- ↑ Carbon Dioxide through Geologic Time. In: Geoscience Research Division at Scripps Institution of Oceanography. Abgerufen am 21. Dezember 2013.
- ↑ U. Siegenthaler: Stable Carbon Cycle-Climate Relationship During the Late Pleistocene. In: Science. 310, 2005, S. 1313–1317, doi:10.1126/science.1120130.
- ↑ Iain Colin Prentice et al.: The Carbon Cycle and Atmospheric Carbon Dioxide. In: [[Dritter Sachstandsbericht des IPCC|IPCC Third Assessment Report]]. 2001, S. 185. Abgerufen am 21. Dezember 2013.
- ↑ a b J. G. Canadell, C. Le Quere, M. R. Raupach, C. B. Field, E. T. Buitenhuis, P. Ciais, T. J. Conway, N. P. Gillett, R. A. Houghton, G. Marland: Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks. In: Proceedings of the National Academy of Sciences. 104, 2007, S. 18866–18870, doi:10.1073/pnas.0702737104.
- ↑ GRID-Arendal: Vital Climate Graphics: The present carbon cycle. In: Grid Arendal. Abgerufen am 21. Dezember 2013.
- ↑ John Cook: John Cook: Behauptung: „Der CO2-Anstieg ist nicht Ursache, sondern Folge des Klimawandels“. In: Klimafakten.de. Abgerufen am 21. Dezember 2013.
- ↑ Gerald A. Meehl, Warren M. Washington, Caspar M. Ammann, Julie M. Arblaster, T. M. L. Wigley, Claudia Tebaldi: Combinations of Natural and Anthropogenic Forcings in Twentieth-Century Climate. In: Journal of Climate. 17, 2004, S. 3721–3727, doi:10.1175/1520-0442(2004)017<3721:CONAAF>2.0.CO;2.
- ↑ James Hansen, Makiko Sato, Reto Ruedy, Larissa Nazarenko, Andrew Lacis, Gavin A. Schmidt, Gary Russell et al.: Efficacy of climate forcings. In: Journal of Geophysical Research. Vol. 110, Issue D18, 27. September 2005, doi:10.1029/2005JD005776
- ↑ Zhenhao Duan, Rui Sun: An improved model calculating CO2 solubility in pure water and aqueous NaCl solutions from 273 to 533 K and from 0 to 2000 bar. In: Chemical Geology. 193, 2003, S. 257–271, doi:10.1016/S0009-2541(02)00263-2.
- ↑ How Long Can the Ocean Slow Global Warming? In: Woods Hole Oceanographic Institution. Abgerufen am 21. Dezember 2013.
- ↑ Tom Garrison: Oceanography: an invitation to marine science, 2005, Verlag Thomson Brooks/Cole, Belmont, CA, ISBN 0-534-40887-7
- ↑ J. B. Ries, A. L. Cohen, D. C. McCorkle: Marine calcifiers exhibit mixed responses to CO2-induced ocean acidification. In: Geology. 37, 2009, S. 1131–1134, doi:10.1130/G30210A.1.
- ↑ Killer-Seen Lautloser Tod aus der Tiefe. In: Der Spiegel. Abgerufen am 21. Dezember 2012.
- ↑ Michel Halbwachs, Klaus Tietze, Andreas Lorke, Clément Mudaheranwa: Investigations in Lake Kivu after the Nyiragongo Eruption of January 2002, bei eawag.ch. (PDF; 2,5 MB) 9. März 2002, abgerufen am 21. Dezember 2012.
- ↑ The Atmosphere of Venus. In: Department of Physics and Astronomy Georgie State University. Abgerufen am 22. März 2010.
- ↑ Kohlendioxid (fast) pur … Atmosphäre und Klima des Roten Planeten. In: Scinexx, das Wissensmagazin. Abgerufen am 22. März 2010.
- ↑ E. Lellouch, B. Bezard, J.I. Moses, G.R. Davis, P. Drossart, H. Feuchtgruber, E.A. Bergin, R. Moreno, T. Encrenaz: The Origin of Water Vapor and Carbon Dioxide in Jupiter's Stratosphere. In: Icarus. 159, 2002, S. 112–131, doi:10.1006/icar.2002.6929.
- ↑ Dale P. Cruikshank, Allan W. Meyer, Robert H. Brown, Roger N. Clark, Ralf Jaumann, Katrin Stephan, Charles A. Hibbitts, Scott A. Sandford, Rachel M.E. Mastrapa, Gianrico Filacchione, Cristina M. Dalle Ore, Philip D. Nicholson, Bonnie J. Buratti, Thomas B. McCord, Robert M. Nelson, J. Brad Dalton, Kevin H. Baines, Dennis L. Matson: Carbon dioxide on the satellites of Saturn: Results from the Cassini VIMS investigation and revisions to the VIMS wavelength scale. In: Icarus. 206, 2010, S. 561–572, doi:10.1016/j.icarus.2009.07.012.
- ↑ Hubble finds carbon dioxide on an extrasolar planet. In: Inoovations-Report, Forum für Wissenschaft, Industrie und Wirtschaft. 10. Dezember 2008, abgerufen am 22. März 2010.
- ↑ L.B. d'Hendecourt, M. Jourdain de Muizon: The discovery of interstellar carbon dioxide. In: Astronomy and Astrophysics, 223 (1989): S. L5-L8.
- ↑ Rebecca L. Rawls: Interstellar Chemistry. In: Department of Physics, Ohio State University. 15. Juli 2002, abgerufen am 21. Dezember 2013.
- ↑ D. Talbi, E. Herbst: The gas-phase destruction of interstellar carbon dioxide: Calculations on the reactions between CO2 and H2 and between CO2 and H. In: Astronomy and Astrophysics. 386, 2002, S. 1139–1142, doi:10.1051/0004-6361:20020312.
- ↑ Verwertung und Speicherung von CO2. (PDF; 410 kB) In: Verband der Chemischen Industrie. 12. Januar 2009, abgerufen am 22. März 2010.
- ↑ o.A.: Schülerduden Chemie, Bibliografisches Institut & F.A. Brockhaus AG, Mannheim 2007, ISBN 978-3-411-05386-5, S. 195.
- ↑ G. Hochgesand: Anwendung von Absorptionsverfahren für die CO2-Entfernung aus Natur- und Synthesegasen. In: Chemie Ingenieur Technik – CIT. 40, 1968, S. 432–440, doi:10.1002/cite.330400904.
- ↑ Birgit Kessler, Jörg Von Eysmondt, Heinrich Merten: Nutzung von CO2 aus Rauchgasen für chemische Synthesen. In: Chemie Ingenieur Technik. 64, 1992, S. 1075–1083, doi:10.1002/cite.330641207.
- ↑ H. Erdmann: Introduction to Chemical Preparations. 160 Seiten, Verlag BiblioBazaar (2009), ISBN 0-559-91360-5})
- ↑ A. Simon und K. Peters: Single-crystal refinement of the structure of carbon dioxide. In: Acta Crystallographica Section B. 1980, B36, S. 2750–2751, doi:10.1107/S0567740880009879.
- ↑ David R. Lide (Hrsg.): CRC Handbook Of Chemistry And Physics. 85. Auflage, CRC Press LLC, 2004, S. 6–53 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der anorganischen Chemie. 101. Auflage, deGruyter, 1995, ISBN 3-11-012641-9, S. 860 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Roland Benedix: Bauchemie. Vieweg+Teubner Verlag, ISBN 978-3-8348-0584-3 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hans-Dieter Barke: Chemiedidaktik heute. 2001, Springer-Verlag, Berlin, ISBN 3-540-41725-7 eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Verordnung zur Änderung lebensmittelrechtlicher und tabakrechtlicher Bestimmungen. In: Bundesanzeiger Verlag. Abgerufen am 22. März 2010.
- ↑ Feuerwehr zu Gasunfall: "Keine Einsatz-Fehler". In: Rheinische Post. Abgerufen am 21. Dezember 2013.
- ↑ Carbon Dioxide as a Fire Suppressant: Examining the Risks. In: U.S. Environmental Protection Agency. Abgerufen am 22. März 2010.
- ↑ Kohlendioxid – Besonderheiten und Einsatzchancen als Kältemittel. In: Deutscher Klima- und Kältetechnischer Verein. Abgerufen am 22. März 2010.
- ↑ Natürliches Kältemittel für Pkw-Klimaanlagen. In: Umweltbundesamt. 9. Juni 2008, abgerufen am 22. März 2010.
- ↑ Metall-Aktivgasschweißen (MAG/135). (PDF; 42 kB) In: Deutscher Verband für Schweißen und verwandte Verfahren. Abgerufen am 22. März 2010.
- ↑ Info-Broschüre – Backen mit Hefe. In: Adler-Mühle. Abgerufen am 22. März 2010.
- ↑ Douglas A. Skoog, James J. Leary, S. Hoffstetter-Kuhn: Instrumentelle Analytik: Grundlagen – Geräte – Anwendungen. Springer-Verlag, ISBN 3-540-60450-2 (Auszug in der Google-Buchsuche)
- ↑ Druckgase zur Versorgung von Getränkeschankanlagen. In: Berufsgenossenschaft Nahrungsmittel und Gastgewerbe. Abgerufen am 22. März 2010.
- ↑ Merkblatt – Verwendung von Nebelgeräten. Abgerufen am 22. März 2010.
- ↑ Simon Motschmann: Technologie – CO2-Schneestrahlen. In: Fraunhofer-Institut für Produktionsanlagen und Konstruktionstechnik IPK. Abgerufen am 22. März 2010.
- ↑ Die Weine aus dem Beaujolais – Macération semi-carbonique, bei winety.com. Abgerufen am 22. März 2010.
- ↑ Saul Norman Katz: Verfahren zum Entkoffeinieren von Kaffee mit einer superkritischen Flüssigkeit. Abgerufen am 21. Dezember 2013.
- ↑ N. Dahmen, P. Griesheimer, A. Hebach: Reinigung und Oberflächenbehandlung mit komprimiertem Kohlendioxid. In: Galvanotechnik, 98 (2007) S. 1111–1120.
- ↑ F. M. Orr, J. J. Taber: Use of Carbon Dioxide in Enhanced Oil Recovery. In: Science. 224, 1984, S. 563–569, doi:10.1126/science.224.4649.563.
- ↑ a b Arno Behr: Katalytische Kohlendioxid-Chemie. In: Aktuelle Wochenschau der GDCh. Abgerufen am 21. Dezember 2013.
- ↑ A. Behr, P. Ebbinghaus, F. Naendrup: Verfahrenskonzepte für die Übergangsmetallkatalysierten Synthesen von Ameisensäure und Dimethylformamid auf der Basis von Kohlendioxid. In: Chemie Ingenieur Technik. 75, , S. 877–883, doi:10.1002/cite.200303221.
- ↑ H. Kolbe et al. Ueber Synthese der Salicylsäure. In: Liebigs Ann, 113 (1860): S. 125-127.
- ↑ Grünes Benzin aus Kohlenstoffdioxid. In: IDW-Online. Abgerufen am 21. Dezember 2013.
- ↑ Sebastian Matthes, Susanne Donner: Der Klimakiller als Rohstoff. In: Wirtschaftswoche online. 16. September 2012, abgerufen am 21. Dezember 2013.
- ↑ Kohlenstoffrecycling. In: IDW-Online. Abgerufen am 21. Dezember 2013.
- ↑ Christophe Das Neves Gomes, Olivier Jacquet, Claude Villiers, Pierre Thury, Michel Ephritikhine, Thibault Cantat: A Diagonal Approach to Chemical Recycling of Carbon Dioxide: Organocatalytic Transformation for the Reductive Functionalization of CO2. In: Angewandte Chemie. 124, 2012, S. 191–194, doi:10.1002/ange.201105516.
- ↑ Sebastian Wesselbaum, Thorsten vom Stein, Jürgen Klankermayer, Walter Leitner: Hydrogenation of Carbon Dioxide to Methanol by Using a Homogeneous Ruthenium-Phosphine Catalyst. In: Angewandte Chemie. 124, 2012, S. 7617–7620, doi:10.1002/ange.201202320.
- ↑ Sebastian Wesselbaum, Ulrich Hintermair, Walter Leitner: Continuous-Flow Hydrogenation of Carbon Dioxide to Pure Formic Acid using an Integrated scCO2 Process with Immobilized Catalyst and Base. In: Angewandte Chemie. 124, 2012, S. 8713–8716, doi:10.1002/ange.201203185.
- ↑ Ralte Lalrempuia, Manuel Iglesias, Victor Polo, Pablo J. Sanz Miguel, Francisco J. Fernández-Alvarez, Jesús J. Pérez-Torrente, Luis A. Oro: Effective Fixation of CO2 by Iridium-Catalyzed Hydrosilylation. In: Angewandte Chemie. 124, 2012, S. 12996–12999, doi:10.1002/ange.201206165.
- ↑ Stefan Pelzer: Maßgeschneiderte Mikroorganismen. In: Biologie in unserer Zeit. 42, 2012, S. 98–106, doi:10.1002/biuz.201210472.
- ↑ A. A. LaVerne: Rapid coma technique of carbon dioxide inhalation therapy. In: Diseases of the nervous system, 14.5 (1953): S. 141.
- ↑ a b J. Wallace, J. Sanford, M. W. Smith und K. V. Spencer (1990): The assessment and control of the severity of scientific procedures on laboratory animals. Report of the Laboratory Animal Science Association Working Party. Laboratory Animals 24 (2), S. 97–130.
- ↑ Schlachthöfe: Tobsucht im Tiefschlaf. In: Der Spiegel. 1. Oktober 1990, abgerufen am 22. Dezember 2013.
- ↑ T. Frieling: Diagnostik bei anorektalen Erkrankungen. In: Praxis 96.7 (2007): S. 243-247.
- ↑ S. C. Wong: Elevated atmospheric partial pressure of CO2 and plant growth. In: Oecologia. 44, 1979, S. 68–74, doi:10.1007/BF00346400.
- ↑ Pflanzenpflege in Aquarien. In: Mongabay.com. Abgerufen am 22. Dezember 2013.
- ↑ Y. T. Qiu, J. Spitzen, R. S. Smallegange, B. G. J. Knols: Monitor systems for adult insect pests and disease vectors. In: W. Takken & B.G.J. Knols (Hrg.) Ecology and control of vector-borne diseases, volume 1: Emerging pests and vector-borne diseases in Europe. Wagening Academic Publishers. S. 329–353, ISBN 978-90-8686-053-1
- ↑ UBA, Bekanntmachung des Umweltbundesamtes: Gesundheitliche Bewertung von Kohlendioxid in der Innenraumluft. In: Bundesgesundheitsblatt-Gesundheitsforsch-Gesundheitsschutz 51 (2008): S. 1358–1369.
- ↑ Sicherheitsdatenblatt - Kohlendioxid (tiefkalt verflüssigt). In: Tyczka Kohlensäure. Abgerufen am 21. Dezember 2013..
- ↑ Rauchvergiftungen/Vergiftungen durch Gase. In: Techniker Krankenkasse. Abgerufen am 21. Dezember 2013.
- ↑ Erste Hilfe bei Kohlenstoffdioxid-Vergiftung. In: Deutsches Rotes Kreuz. Abgerufen am 21. Dezember 2013.
- ↑ Carbon Dioxide – Life and Death. In: Sensair. Abgerufen am 21. Dezember 2013..
- ↑ Bodo Gorgaß,Friedrich W. Ahnefeld, Rolando Rossi: Rettungsassistent und Rettungssanitäter, 1997, Springer Verlag, 868 Seiten, ISBN 3-540-21487-9, S. 305-314
- ↑ Ester Majo: I fenomeni vulcanici della grotta del Cane (Campi Flegrei) in rapporto alle variazioni atmosferiche. In: Bulletin Volcanologique. 4, 1927, S. 84–92, doi:10.1007/BF02719519.
- ↑ avid W. Christianson, Carol A. Fierke: Carbonic anhydrase: Evolution of the zinc binding site by nature and by design. In: Accounts of Chemical Research 29.7 (1996): S, 331-339.
- ↑ Peter Karlson: Karlsons Biochemie und Pathobiochemie. 2005, Thieme-Verlag, Stuttgart, ISBN 3-13-357815-4 (Auszug in der Google-Buchsuche)
- ↑ Schwarz, Meier: Carbon toxicity in plants. In: International Symposium on Growing Media and Hydroponics, S. 481. 1997.
- ↑ Heinz-Gerhard Franck, Jürgen W. Stadelhofer: Sauerstoff und Kohlendioxid ? Schlüsselverbindungen des Lebens. In: Naturwissenschaften. 75, 1988, S. 585–590, doi:10.1007/BF00366470.
- ↑ Wolfgang Thüne: Kohlendioxid – Unverzichtbar für das Leben. In: Pharmazeutische Zeitung online. 2008, abgerufen am 22. Dezember 2013.
- ↑ Christian Schwägerl: Forscher fordern Säure-Limit für Ozeane. In: Der Spiegel. 14. Dezember 2009, abgerufen am 21. Dezember 2013.
- ↑ Kurt Bauer: Zur Bedeutung der Kohlensäure in Karpfenteichen. In: Österreichs Fischerei, 44/1991, S. 49–64.
- ↑ W. Elbert, B. Weber, S. Burrows u. a.: Contribution of cryptogamic covers to the global cycles of carbon and nitrogen. In: Nature Geoscience. Band 5, Nr. 7, 3. Juni 2012, ISSN 1752-0894, S. 459–462, doi:10.1038/ngeo1486.
- ↑ Sabine Wendler: Unscheinbar und doch gewaltig: Flechten, Algen und Moose sind Großspeicher für Stickstoff und CO2. In: IDW-Online. 4. Juni 2012, abgerufen am 22. Dezember 2013.
- ↑ Eberhard Fritz: Klimaerwärmung kann sich über Freisetzung von CO2 aus Waldböden selbst verstärken. In: IDW-Online. 11. Juni 2012, abgerufen am 22. Dezember 2013.
- ↑ Adrianus Kleinleugenmors: Vorrichtung zur Messung des Partialdrucks von Kohlendioxid. In: Europäisches Patent. 4. Dezember 2006, abgerufen am 21. Dezember 2013.
- ↑ Arthur Adel, David Dennison: The Infrared Spectrum of Carbon Dioxide. Part I. In: Physical Review. 43, 1933, S. 716–723, doi:10.1103/PhysRev.43.716.