Lithium-Ionen-Akkumulator


Lithium-Ionen-Akkumulator ([]-) oder Lithium-Akkumulator (auch Lithiumionenakku, Lithiumionen-Akku, Lithiumionen-Sekundärbatterie) ist der Sammelbegriff für Akkumulatoren auf der Basis von Lithium-Verbindungen in allen drei Phasen der elektrochemischen Zelle. Die reaktiven Materialien – der negativen und der positiven Elektrode und des Elektrolyten – enthalten Lithiumionen.
Es gibt zahlreiche verschiedene Lithium-Ionen-Akkumulatoren. Sie unterscheiden sich nicht nur in der Größe und Bauform, sondern auch in der chemischen Zusammensetzung ihrer Komponenten und haben auch verschiedene Spannungsbereiche. Für etwa zwei Jahrzehnte waren die meisten der auf den Markt gebrachten lithiumbasierten Akkumulatoren Lithium-Cobaltdioxid-Akkumulatoren. Heute werden vor allem die auf Lithium-Nickel-Mangan-Cobalt-Oxiden basierenden NMC-Akkumulatoren verkauft.[1]
Die meisten Lithium-Ionen-Akkumulatoren zeichnen sich durch eine höhere spezifische Energie (Energie pro Eigenmasse) als andere Akkumulatortypen aus. Auf Tiefentladung und auf Überladung reagieren sie meist nachteilig und brauchen deshalb ein geeignetes Batteriemanagementsystem (BMS). Die Kenndaten wie Zellspannung, Temperaturempfindlichkeit, Lade- und Entladeschlussspannung und der maximal erlaubte Lade- oder Entladestrom variieren bauartbedingt und sind wesentlich vom eingesetzten Elektrodenmaterial und Elektrolyten abhängig. Die Angabe des genauen Typs, beispielsweise Lithium-Eisenphosphat-Akkumulator, ist aus diesem Grund informativer als die unspezifische Angabe des Oberbegriffs Lithium-Ionen-Akkumulator. Zusätzlich zu den Varianten aufgrund der Elektrodenmaterialien gibt es Varianten aufgrund verschiedener Elektrolyte: die Zelle kann einen flüssigen Elektrolyten enthalten oder als Lithium-Polymer-Akkumulator ausgeführt sein.[2]
Geschichte[Bearbeiten | Quelltext bearbeiten]
Bereits in den 1970er Jahren wurden an der TU München das grundlegende Funktionsprinzip der reversiblen Alkalimetallionen-Interkalation in Kohlenstoff-Elektroden[3][4] sowie oxidische Elektroden[5][6] und deren Anwendung in Lithium-Batterien[7][8] erforscht und veröffentlicht (Jürgen Otto Besenhard und andere), auch wenn damals die praktische Anwendbarkeit als Elektroden für Lithium-Batterien nicht erkannt wurde. In den 1970er Jahren fand Stanley Whittingham ein vielversprechendes Kathodenmaterial für Lithiumbatterien in Form von Titandisulfid, das in seinen atomaren Zwischenräumen Lithiumionen aufnehmen kann.[9] Mit einer Anode aus metallischem Lithium liefert eine Titandisulfid-Zelle eine Spannung von etwa 2 Volt. In der Zeit von 1977 bis 1979 wurden kleine Titandisulfid-Zellen mit einer Lithiumlegierung statt mit Lithium für Uhren verkauft.[10]
In den späten 1970er Jahren schlug Michel Armand ein Akkumulatorkonzept vor, bei dem sowohl an der Pluspolseite als auch an der Minuspolseite strukturstabile feste Materialien verwendet werden, die Lithium aufnehmen und wieder abgeben können, d. h. Interkalationsmaterialien.[11] Beim Laden und Entladen pendeln Lithiumionen zwischen den Elektroden hin und her; das Konzept wurde wegen der Hin- und Herbewegung „Schaukelstuhlakku“ (rocking chair battery) genannt.[11] Bruno Scrosati baute die ersten entsprechenden Zellen und vermaß den Spannungsverlauf beim 70-maligen Laden und Entladen.[11][12] Damit war das Prinzip des Lithium-Ionen-Akkumulators gefunden, es fehlten aber noch die für eine Kommerzialisierung nötigen kostengünstigen, möglichst leichten Materialien mit hoher Spannung.
Die Brauchbarkeit von Lithium-Cobalt(III)-oxid als Elektrodenmaterial für die Pluspolseite (bei der Entladung Kathode) wurde 1980 von einer Forschergruppe um John B. Goodenough beschrieben, der an der University of Oxford arbeitete.[13] Goodenough fand das Material nach systematischer Suche, ausgehend davon, dass er ein Metalloxid mit eingelagerten Lithiumionen für vielversprechender hielt als das Metallsulfid von Whittingham.[9] Er erreichte Zellspannungen von 4 Volt. Die erfolgreiche industrielle Umsetzung gelang zuerst 1985 in Japan durch Akira Yoshino, Chemiker bei Asahi Kasei. Er baute auf dem Kathodenkonzept von Goodenough auf und verwendete für die Anode statt des reaktiven metallischen Lithiums Graphit, das Lithiumionen aufnehmen kann. Ein Vorteil neben dem relativ geringen Gewicht von Graphit ist seine hohe Haltbarkeit, da er als Interkalationsmaterial Lithiumionen aufnimmt, ohne dass das Elektrodenmaterial durch die chemische Reaktion mit dem Lithium „aufgebrochen“ wird.[9]
Der erste kommerziell erhältliche Lithium-Ionen-Akku war damit der Lithium-Cobaltdioxid-Akkumulator, auch LiCoO2-Akku, der von Sony im Jahr 1991 auf den Markt gebracht und in der Hi8-Videokamera CCD TR 1 eingesetzt wurde. Die Batterie aus zwei seriell verschalteten Zellen hatte eine Spannung von 7,2 V und eine Kapazität von etwa 1200 mAh. Bis heute (2016) werden Akkumulatoren dieser Bauform mit Kapazitäten bis 6900 mAh angeboten und in einer Vielzahl von Geräten eingesetzt.[14]
Whittingham, Goodenough und Yoshino erhielten 2019 für die Entwicklung der Lithium-Ionen-Batterie den Nobelpreis für Chemie.
Die Möglichkeit, das Graphit auf der Anodenseite durch Silizium zu ersetzen, wurde lange erforscht. Bei Graphit werden sechs Kohlenstoffatome benötigt, um ein Lithiumion zu binden, während ein Siliziumatom gleich vier Lithiumionen binden kann. Die theoretisch zehnfach höhere Leistungsdichte kann jedoch nicht voll ausgenutzt werden, da dann das Anodenmaterial auf die vierfache Größe aufquillt, was diese nach einigen Ladezyklen zerstört.[15] Die Stabilisierung des Anodenmaterials wurde in einer Reihe von Ansätzen untersucht, die 2008 gegründete Ampirius gilt hier als Wegbereiter. Mitte der 2010er investierten mehrere Autohersteller in die Weiterentwicklung.[16] Neben der Nanostrukturierung wurde dabei zuerst die Silizium/Kohlenstoff-Komposit-Anode zur Marktreife entwickelt. Die Massenproduktion von Batterien mit diesem Anodenmaterial setzte zwischen 2022 (Ampirius)[17] und 2024 (Varta/Samsung/Group14)[18][19][20] ein. Es wird erwartet, dass Silizium und Silizium-Komposite bis 2030 die reinen Graphit-Anoden weitgehend verdrängen werden.[21]
Die Verwendung von Graphit und Silizium wird als Zwischenschritt zu Lithium-Metall-Anoden gesehen, die eine höhere volumetrischen Energiedichte aufweisen.[22] Dieses Material wird in der Forschung wesentlich beim Lithium-Schwefel-Akkumulator untersucht. Im Jahr 2020 fanden Forscher der Columbia University heraus, dass die Zugabe von Kalium Lithium-Metall-Akkumulatoren (nicht: Lithium-Ionen-Akkumulatoren) langlebiger und sicherer macht. So verhindere das Kalium unerwünschte chemische Nebenreaktionen.[23][24] In einer Arbeit mit einem neuen Elektrolyten am Helmholtz-Institut Ulm konnte 2021 eine hohe Stabilität erreicht werden, wobei eine Energiedichte der Zellen von 560 Wh/kg erreicht wurde.[25] Man geht für Lithium-Metall-Anoden nicht von einer Einsetzbarkeit vor 2028 aus.[21]
Anwendung[Bearbeiten | Quelltext bearbeiten]

Lithium-Ionen-Akkus versorgten anfangs hauptsächlich tragbare Geräte mit hohem Energiebedarf, für die herkömmliche Nickel-Cadmium- oder Nickel-Metallhydrid-Akkus zu schwer oder zu groß waren, beispielsweise Mobiltelefone, Tablets, Digitalkameras, Camcorder, Notebooks, Handheld-Konsolen, Softairwaffen oder Taschenlampen. Mittlerweile sind sie in fast allen Bereichen anzutreffen. Sie dienen bei der Elektromobilität als Energiespeicher für Pedelecs, Elektroautos, moderne Elektrorollstühle und Hybridfahrzeuge. Das Fraunhofer-Institut für System- und Innovationsforschung ISI erwartete 2020, dass die Nachfrage nach Lithium-Ionen-Zellen allein für die Elektromobilität bis 2030 um den Faktor 20 bis 40 steigen wird.[26]
Auch im RC-Modellbau haben sie sich früh etabliert. Durch ihr geringes Gewicht sind sie, in Verbindung mit bürstenlosen Gleichstrommotoren und den entsprechenden Reglern, gut als Antriebseinheit im Flugmodellbau geeignet. Seit 2003 gibt es Lithium-Ionen-Akkus in Elektrowerkzeugen wie zum Beispiel Akkuschraubern und in Gartengeräten. In der Boeing 787 werden Lithium-Cobaltdioxid-Akkumulatoren (LiCoO2) verwendet. Sie erhielten nach mehreren Bränden nachträglich eine Stahlummantelung. Andere Flugzeuge sind (2012) mit Lithium-Eisenphosphat-Akkus ausgerüstet.[27] Lithium-Ionen-Batterie-Systeme werden auch in Batteriespeichern eingesetzt.
Prinzip[Bearbeiten | Quelltext bearbeiten]

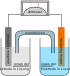
Im geladenen Lithium-Ionen-Akkumulator wird die elektrische Potentialdifferenz der Elektroden in einem elektrochemischen Prozess mit Stoffänderung der Elektroden zur Stromerzeugung genutzt. Im Akkumulator können Lithiumionen (Li+) frei durch den Elektrolyten zwischen den beiden Elektroden wandern, wovon sich der Name des Akkus ableitet. Im Gegensatz zu den Lithiumionen sind die Übergangsmetall- und Graphit-Strukturen der Elektroden ortsfest und durch einen Separator vor einem direkten Kontakt geschützt. Die Mobilität der Lithiumionen ist zum Ausgleich des externen Stromflusses beim Laden und Entladen nötig, damit die Elektroden selbst (weitgehend) elektrisch neutral bleiben.
Die negative Elektrode ist eine Graphit-Interkalationsverbindung mit der allgemeinen Zusammensetzung LixCn, wobei Lithium als Kation vorliegt. Beim Entladen gibt die Interkalationsverbindung Elektronen ab, die über den externen Stromkreis zur positiven Elektrode fließen. Gleichzeitig wandern gleich viele Li+-Ionen aus der Intercalationsverbindung durch den Elektrolyten ebenfalls zur positiven Elektrode. An der positiven Elektrode nehmen nicht die Lithiumionen die Elektronen des externen Stromkreises auf, sondern die dort vorhandenen Strukturen der Übergangsmetallverbindungen. Je nach Akkumulatortyp können das Cobalt-, Nickel-, Mangan- oder Eisen-Ionen sein, die ihre Ladung ändern. Das Lithium liegt im entladenen Zustand des Akkumulators in der positiven Elektrode weiterhin in Ionenform vor.
Da die Affinität der Lithiumionen zum Material der positiven Elektrode größer ist als ihre Affinität zur negativen (Graphit-)Elektrode, wird beim Fließen von Lithiumionen von der negativen zur positiven Elektrode Energie freigesetzt.
Innerhalb beider Elektroden können sich Elektronen als Elektronengas frei bewegen und zu den externen Leitern wandern bzw. aus den Leitern in die Elektrode eintreten, nicht jedoch zwischen den Elektroden innerhalb des Akkumulators wandern. Die Trennwand (Separator) ist elektronenundurchlässig, was einen Kurzschluss verhindert.
Aufbau[Bearbeiten | Quelltext bearbeiten]

Während der Aufbau der ersten Akkumulatoren noch darin bestand, die Elektroden in den Elektrolyten zu tauchen, ist bei Lithium-Akkumulatoren der Schichtaufbau üblich. Die Elektrodenmaterialien werden dazu in eine streichbare Paste geformt und auf eine Folie aufgetragen, die als Stromableiter fungiert. Zwischen die Folien der Elektroden wird eine dritte Folie als Separator eingelegt.
Dieser Stapel aus Folien wird für den Zusammenbau in einer Batterie dann geschnitten, gewickelt oder gefaltet. Bei einer Rundzelle entsteht aus dem Stapel eine Rolle, die in einen zylindrischen Behälter geschoben wird, und gegebenenfalls mit einem Elektrolyten aufgefüllt wird, um dann den Behälter dicht zu verschließen. Es gibt jedoch auch eine Reihe von flachen Bauformen.
Mehrere Batteriezellen können dann noch zu einem Batteriepack zusammengesetzt werden, insbesondere um eine gewünschte Voltzahl zu erreichen. Bekannt sind hier der 9-Volt-Block, der für verschiedenste Zellchemien eingesetzt werden kann, und die Traktionsbatterien für Elektrofahrzeuge mit typisch 400 Volt Nennspannung.
Produktion[Bearbeiten | Quelltext bearbeiten]



In der Serienherstellung werden die Folien als Endlosband über Rollen geführt. Die Herstellung von Lithium-Ionen-Batteriezellen umfasst dabei die drei Hauptprozessschritte Elektrodenfertigung, Zell-Assemblierung und Zell-Finishing.[28] Die Fertigungsstraßen für die Elektrodenfertigung („Coating“-line) und Zell-Assemblierung („Assembly“-line) werden hierbei getrennt aufgebaut.[29]
In der Elektrodenfertigung werden die getrennten Ausgangsstoffe in einer Mischtrommel zu einer Paste (sogenannter „Slurry“) verbunden. Neben den Aktivmaterialien kommen hier Leitadditive, Lösungs- und Bindemittel hinzu. Über Rohrleitungen wird das Material zum Beschichten gepumpt. Auf eine angelieferte Trägerfolie (aus Aluminium oder Kupfer) wird die Paste aufgetragen (mit einer Schlitzdüse, Rakel oder Rasterwalze) und anschließend in einen Trockner überführt, in dem das Lösungsmittel verdampft. Die Foliendicken schwanken je nach Zelldesign zwischen 5 μm und 25 μm. Die Trockenschichtdicke liegt pro Seite zwischen 40 und 100 μm. Die Trocknerzonen können bis zu 100 m lang sein und bis zu 160 °C heiß. Nach dem Trocken werden die Elektrodenfolien noch durch ein Walzenpaar verdichtet (sogenanntes „Kalandern“). Anschließend wird die breite Trägerfolie, mit bis zu 1500mm Breite, in schmalere Streifen geschnitten (sogenanntes „Slitting“), wie sie für den folgenden Zusammenbau gebraucht werden. Die schmaleren Elektrodenfolien werden wieder aufgerollt (sogenannte „Coils“). Die Elektrodenrollen werden dann in einem Vakuumofen gestapelt, um dem Material die Restfeuchte zu entziehen. Die Trocknungszeit beträgt bis zu 30h. Statt die Elektrodenfolien zu stapeln gibt es für diese Trocknung auch Endlosverfahren im abgerollten Zustand, wobei diese Produktionsanlagen entsprechend groß und teuer sind.[28]
Der Hochlauf der Elektrodenfertigung ist besonders langwierig - von der genauen Mixtur der Eingangsstoffe über Temperatur und Druck sowie Bandgeschwindigkeit will man zu einer besonders gleichmäßigen Trockenschichtdicke ohne Oberflächenfehler kommen.[30] War die Bandgeschwindigkeit lange auf 30 bis 40 Meter pro Minute begrenzt, ist man aktuell bei 70 bis 80 Meter pro Minute, und in der Entwicklung sind 150 Meter pro Minute.[28][30][31] Die Materialkosten und Trocknung machen einen wesentlichen Teil der Kosten der Zellherstellung aus (über 80 %).[30]
Die zwei Elektrodenfolien sowie mindestens eine Trennfolie mit dem Separator kommen dann als Rollware zur Zell-Assemblierung (beziehungsweise Zell-Montage[30]). Beim Vereinzeln werden die Elektrodenfolien abgetrennt, bei einer Pouch-Zelle werden dabei rechteckige Stücke herausgestanzt (sogenannte „Sheets“). Beim Stapeln kommen die Folien dann übereinander, wobei für Pouch-Zellen das Z-Folding üblich ist – der Separator kommt als Endlosband, das abwechselnd geknickt wird, und die Stücke dazwischen eingelegt werden. Je nach Zellspezifikation kann so ein Zellstapel aus bis zu 120 Einzellagen bestehen. Alternativ gibt es Laminationsverfahren für einen kontinuierlichen Prozess, in dem die drei Rollen direkt mit einem Wärmeeintrag verpresst werden, und anschließend geschnitten werden. Bei Rundzellen erfolgt die Zell-Assemblierung stattdessen durch Wickeln. Das gewickelte Erzeugnis (sogenannte „Jelly-Roll“) wird mit einem Klebestreifen gesichert. Der entstehende Stapel oder die entstehende Rolle wird anschließend kontaktiert und in eine Verpackung eingelegt. Die Verpackung wird schließlich mit dem Elektrolyten befüllt und versiegelt.[28]
Das Zell-Finishing beinhaltet zusätzliche Schritte nach der Zusammenfügung mit dem Verpackungsmaterial. Dazu kann ein Rütteltisch gehören, damit die Elektroden gleichmäßig mit dem Elektrolyt benetzt werden. Bei Pouch-Zellen kommt eine Pressung hinzu, das bei Endlosverfahren über eine Walze geführt wird. Die Batterien brauchen dann noch eine erste Serie von Ladevorgängen, bei der sich die eigentlichen Lithium-Ionen in der Kristallstruktur bilden (sogenanntes „Forming“). Die Parameter an Strom- und Spannungsverläufen sind sehr spezifisch für die Zelltypen und ausschlaggebend für Leistungsfähigkeit und Haltbarkeit des Endproduktes. Dabei können Gase entstehen, die beim Entgasen abgesaugt werden. Bei der Reifung werden die Zellen bis zu drei Wochen gelagert und regelmäßig die Nennspannung geprüft. Der abschließende Test (sogenanntes „EOL-Testing“) umfasst neben der Spannung auch Widerstandsmessungen und Dichtigkeitsprüfungen.[28]
Ausführungsformen[Bearbeiten | Quelltext bearbeiten]
Zellchemie[Bearbeiten | Quelltext bearbeiten]
Im Gegensatz zu den nicht wiederaufladbaren Lithiumbatterien und der Gruppe von Lithiumakkumulatoren, die metallisches Lithium im Aufbau nutzen, tritt in Lithium-Ionen-Akkumulatoren kein metallisches Lithium auf – das Lithium wird bei allen heutigen Lithium-Ionen-Akkumulatortypen im Wirtsgitter eines Trägermaterials gebunden.[32] Wenn sich das Wirtsgitter dabei kaum verändert, spricht man von Interkalation. Je nach Typ werden im Rahmen der Herstellung von Akkus mit einer Speicherfähigkeit der Energiemenge von einer Kilowattstunde etwa 80 g bis 130 g chemisch reines Lithium benötigt. Lithium-Ionen, auch die in Akkumulatoren, sind monovalent (Li+), was – verglichen mit multivalenten Ionen wie Mg2+ oder Al3+ – einen wesentlich besseren Transport in Festkörpern erlaubt[33] und damit die Nutzung von Interkalationsprozessen möglich macht. An Materialien werden unter anderem verwendet:
Materialien an der Pluspolseite[Bearbeiten | Quelltext bearbeiten]
Positive Elektrode (beim Entladen: Kathode; beim Laden: Anode)
- Lithium-Cobalt(III)-oxid (LiCoO2, „LCO“) und verwandte Schichtverbindungen. Bei dem Lithium-Cobaltdioxid-Akkumulator besteht die positive Elektrode aus dem namensgebenden Lithium-Cobalt(III)-oxid (LiCoO2). Im Jahr 2008 wurde in etwa 90 % aller verkauften Lithium-Ionen-Akkumulatoren LiCoO2 eingesetzt,[34]
- Lithium-Nickel-Mangan-Cobalt-Oxide kurz NMC oder auch NCM genannt, wie z. B. LiNi0,33Co0,33Mn0,33O2, die Mischoxide aus dem genannten LiCoO2, aus LiNiO2 und LiMnO2 sind. Eine manganfreie Variante ist das Oxid LiNi1−xCoxO2 Mit Stand 2019 galt diese Verbindung als die in Antriebsbatterien am meisten verwendete. Elektroautos einschließlich derer von Daimler oder BMW, aber abgesehen von den Produkten von Tesla und einigen chinesischen Herstellern, verwendeten mit Stand 2019 NMC-Akkumulatoren.
- Lithium-Nickel-Cobalt-Aluminium-Oxid („NCA“, LiNi1−x−yCoxAlyO2) ist eine Version des Lithium-Ionen-Akkumulators mit Lithium-Nickel-Cobalt-Aluminium-Oxid als Kathodenmaterial z. B. LiNi0,85Co0,1Al0,05O2. Dieser Akku zeichnet sich durch hohe Energiedichte (240–270 Wh/kg bei zyl. Zellen im Format 18650) und lange Lebensdauer aus. NCA-Zellen werden als Antriebsbatterie vor allem von Panasonic und Tesla hergestellt.
- Spinelle wie das Lithiummanganoxid LiMn2O4 („LMO“),
- Beim Lithium-Mangan-Akkumulator wird Lithiummanganoxid als cobaltfreies Aktivmaterial in der positiven Elektrode eingesetzt. Die negative Elektrode, bei Entladung des Akkumulators die Anode, besteht entweder aus herkömmlichem Graphit (Hochenergiezellen) oder aus einer amorphen Kohlenstoffstruktur (amorphous carbon, in Hochleistungszellen). Durch die größere Anodenoberfläche ergibt sich eine verbesserte Hochstromfestigkeit. Die Zellen werden mit Stand 2012 sowohl in Pedelecs und E-Bikes verschiedener Hersteller (u. a. vom Schweizer Pedelec-Hersteller Flyer[35][36]), als auch in Hybridelektrokraftfahrzeugen (Bsp.: Nissan Fuga Hybrid, Infinity Mh) und Elektroautos (Bsp.: Nissan Leaf) eingesetzt. Großformatige Zellen für Antriebsbatterien fertigt beispielsweise AESC u. a. für den Nissan Leaf.
- Lithium-Eisenphosphat-Akkumulator (LiFePO4-Akkumulator) ist eine Version des Lithium-Ionen-Akkumulators, bei dem die herkömmliche Lithium-Cobaltoxid-Kathode durch eine Lithium-Eisenphosphat-Kathode ersetzt wurde. Dieser Akku zeichnet sich durch hohe Lade- und Entladeströme, eine sehr gute Temperaturstabilität und eine lange Lebensdauer aus. Die Nominalspannung beträgt 3,2 V beziehungsweise 3,3 V, die Energiedichte beträgt 100–120 Wh/kg. Weiterentwicklungen zur Verbesserung der technischen Eigenschaften sind Dotierungen mit Yttrium- (LiFeYPO4) und Schwefelatomen.
| Bezeichnung | Positive Elektrode: Materialien[37] |
Abkürzungen | Zell- Spannung |
typ. Betriebs- bereich |
Laden (Ladeschluss- Spannung) |
Entladen (Cut-Off- Spannung) |
Spezifische Energie (Wh/kg) |
Lade- zyklen |
|---|---|---|---|---|---|---|---|---|
| Lithium-Cobaltdioxid-Akkumulator | LiCoO2 | ICR, LCO | 3,6 V | 3,0–4,2 V | 0,7–1C (4,2 V) | ≤ 1C (2,5 V) | 150–200 | 500–1000 |
| Lithium-Mangan-Akkumulator | LiMnO2 / LiMn2O4 | IMR, LMO, LMS | 3,7–3,8 V | 3,0–4,2 V | 0,7–1C (4,2 V) | 1C, Hochstrom: 10C (2,5 V) | 100–150 | 300–700 |
| Lithium-Nickel-Mangan-Cobalt-Akkumulator | LiNixMnyCozO2 | INR, NMC, NCM | 3,6–3,7 V | 3,0–4,2 V | 0,7–1C (4,2 V) | 1C, Hochstrom: 2C (2,5 V) | 150–220 | 1000–2000 |
| Lithium-Nickel-Cobalt-Aluminium-Akkumulator | LiNixCoyAlzO2 | NCA | 3,6 V | 3,0–4,2 V | 0,7C (4,2 V) | 1C (3,0 V) | 200–260 | 500 |
| Lithium-Eisenphosphat-Akkumulator | LiFePO4 | IFR, LFP | 3,2–3,3 V | 2,5–3,65 V | 1C (3,65 V) | 1C, Hochstrom: 25C (2,5 V) | 90–120 | 2000 und mehr |
| Lithium-Mangan-Eisenphosphat-Akkumulator | LiMnxFeyPO4 | LMFP | 3,4–4,0 V[38] | 3,8 V[38] | (vergleichbar LiFePO4 – höhere Spannung bringt mehr Wh/kg) | |||
Materialien auf der Minuspolseite[Bearbeiten | Quelltext bearbeiten]
Negative Elektrode (beim Entladen: Anode; beim Laden: Kathode)
- Graphit und verwandte Kohlenstoffe, bei denen eine Interkalation von Lithium stattfindet, sind immer noch die wichtigsten Materialien,
- nanokristallines, amorphes Silicium (Legierungsbildung mit Lithium),
- poröses Silizium, bei Amprius als Silizium-Nanodrähte auf einem Silizium-Nickel-Substrat[39]
- Silizium/Kohlenstoff-Komposite mit einem Gerüst auf Kohlenstoffbasis werden als Silicium-Carbon bezeichnet.[40]
- Silicium/Graphit/Kohlenstoff-Komposite (Si/G/C-Komposite) können teilweise Graphit zur Speicherung einsetzen und in verschiedenen Mischungsverhältnissen Silicium-Partikel in einer Kohlenstoffmatrix zur Leistungssteigerung hinzufügen.[41]
- Lithiumtitanat-Akkumulator ist eine Unterkategorie des Lithium-Ionen-Akkumulators, bei der die herkömmliche Graphitelektrode (negativer Pol) durch eine gesinterte Elektrode aus Lithiumtitanspinell (Li4Ti5O12) ersetzt wird. Die wesentlich stärkere chemische Bindung des Lithiums im Titanat verhindert die Bildung einer Oberflächenschicht, die eine der Hauptgründe für die schnelle Alterung vieler herkömmlicher Li-Ion-Akkus ist. Da das Titanat nicht mehr mit Oxiden aus der Kathode reagieren kann, wird auch das thermische Durchgehen des Akkumulators verhindert, selbst bei mechanischen Schäden. Außerdem kann der Akkumulator aufgrund der Lithiumtitanat-Anode im Gegensatz zu herkömmlichen Lithium-Ionen-Akkus auch bei tiefen Temperaturen in einem Temperaturbereich von −40 bis +55 °C betrieben werden. Nachteilig ist die geringe Speicherdichte und der hohe Preis.
- Zinndioxid (SnO2).
| Bezeichnung | Negative Elektrode: Materialien |
Abk. | Zell- Spannung |
typ. Betriebs- bereich |
Laden (Ladeschluss- Spannung) |
Entladen (Cut-Off- Spannung) |
Spezifische Energie (Wh/kg) |
Lade- zyklen |
|---|---|---|---|---|---|---|---|---|
| Lithium-Graphit-Akkumulator (Standard-Lithium-Ionen-Zelle) | C | C | 3,2–4,0 V | 3,4–3,8 V | 1C | bis zu 10C | 200–260 | |
| Silicium-Carbon-Composite | Si/C | SCC | 2,75–4,2 V[42] | 1C | 330–450[43][44] | 1000 | ||
| Lithiumtitanat-Akkumulator | Li4Ti5O12 | LTO | 2,4 V | 1,8–2,85 V | bis 25C (2,85 V) | bis 70C[45] (2,5 V) | 50–80 | 40.0000 (mit 10C)[46] |
Elektrolyte[Bearbeiten | Quelltext bearbeiten]
Ein Separator hat die Aufgabe, die Elektroden elektrisch zu isolieren, also mindestens den Kontakt der Oberflächen zu unterbinden. Gleichzeitig muss der Separator durchlässig für die Lithium-Ionen sein. Üblich sind flüssige Elektrolyte, wobei der Separator porös genug sein muss, um mit dem Elektrolyt getränkt werden zu können. Das Material des Elektrolyten sollte dabei einen hohen Benetzungsgrad für beide Elektrodenmaterialien aufweisen, um Ionen aus den Oberflächen der Elektroden aufnehmen und abgeben zu können.
Alle genannten Elektrodenmaterialien können mit einem Polymerelektrolyten kombiniert werden, so dass ein Lithium-Polymer-Akkumulator entsteht. Zur Anwendung kommen:
- Salze wie Lithiumhexafluorophosphat (LiPF6), Lithiumtetrafluorborat (LiBF4) oder Lithiumbis(oxalato)borat (LiBOB) gelöst in wasserfreien aprotischen Lösungsmitteln wie z. B. Ethylencarbonat, Propylencarbonat, Dimethylcarbonat, Diethylcarbonat oder 1,2-Dimethoxyethan,[47]
- Polymere aus Polyvinylidenfluorid (PVDF) oder Polyvinylidenfluorid-Hexafluorpropen (PVDF-HFP) im Lithium-Polymer-Akkumulator,
- Lithiumphosphatnitrid (Li3PO4N),
- Lithiumtitanthiophosphat (LiTi2(PS4)3),
- LISICON (Li2+2xZn1−xGeO4).
Separator
- Polyolefin-Membran ohne und mit nanokeramischer Schicht,
- High purity alumina (HPA) Separator.[48]
Stromableiter
- Kupferfolie an der Minuspolseite. Hier verwendet man nicht Aluminium, weil Aluminium an der negativen Elektrode mit Lithium reagieren würde,
- Aluminiumfolie an der Pluspolseite. Hier verwendet man das kostengünstige und leichte Material, das in geeigneten Elektrolyten durch Passivierung vor Korrosion geschützt ist.
Reaktionsgleichungen[Bearbeiten | Quelltext bearbeiten]
Im Folgenden sind beispielhaft die für den Lithium-Mangan-Akkumulator geltenden chemischen Reaktionsgleichungen bei Entladung und Ladung angeführt.
Negative Elektrode (Entladen):
Positive Elektrode (Entladen):
Redox-Gleichung:
Spezielle Bauweisen[Bearbeiten | Quelltext bearbeiten]
Lithium-Polymer-Akkumulator[Bearbeiten | Quelltext bearbeiten]
Der Lithium-Polymer-Akkumulator stellt keine eigenständige Zellchemie dar, wenngleich die Mehrzahl aller am Markt befindlichen Lithium-Polymer-Akkumulatoren vom Typ der Lithium-Cobaltdioxid-Akkumulatoren sind und damit umgangssprachlich oft gleichgesetzt werden. Die wesentliche Eigenschaft des Polymer-Akkumulators ist die Art der Gestaltung des normalerweise flüssigen Elektrolyts, welcher als feste bis gelartige Folie auf Polymerbasis vorliegt und somit im mechanischen Aufbau der Zelle verschiedenartige Gestaltungen wie den Aufbau flacher Zellen erlaubt. Die äußere Form der Lithium-Polymer-Akkus unterliegt praktisch keinen Beschränkungen.
Verschiedenartige Materialkombinationen[Bearbeiten | Quelltext bearbeiten]

Es stehen zahlreiche Materialkombinationen zur Speicherung von Lithiumionen zur Verfügung. Die chemischen Speichermaterialien verändern die Eigenschaften des Akkumulators entscheidend, so dass diese zur Einstellung auf spezielle Anforderungen genutzt werden können. Die Abbildung zeigt zahlreiche Kathoden- und Anodenmaterialien in einer Gegenüberstellung und weist den Potentialunterschied der Materialien aus.
Durch die zusätzliche Verwendung unterschiedlicher spezieller Separatoren (z. B. Keramikseparatoren),[49] Elektrolyte (z. B. Ionische Flüssigkeiten) und Verpackungsmaterialien können weitere Eigenschaften des Akkumulators eingestellt werden, so dass diese auch extremen Anforderungen gerecht werden können.
Als besondere Anforderungen an Lithium-Ionen-Akkumulatoren gelten:
- Maximierung von Energiedichte (gewichts- oder volumenbezogen);
- Schnellladefähigkeit und Leistungsdichte;
- Hoch- und Niedrigtemperaturfestigkeit;
- Stoßfestigkeit und Eigensicherheit;
- Strahlungstoleranz (z. B. Gammastrahlung in der Luft- und Raumfahrt);
- Hoch- und Niederdruckfestigkeit (bis Grobvakuum);
- Spezielle Formfaktoren für Folienkörper oder Anschlusspole;
- Amagnetismus sowie
- Biegeflexibilität.

Obwohl diese Möglichkeiten bestehen, stützt sich die industrielle Massenfertigung auf die Verwendung von etablierten Speichermaterialien, wie z. B. Lithium-Cobalt(III)-oxid und Graphit. Nur wenige Spezialhersteller, wie z. B. das deutsche Unternehmen Custom Cells Itzehoe GmbH und das amerikanische Unternehmen Yardney Technical Products Inc., bieten Sonderlösungen an. Nebenstehende Abbildung zeigt einen vom Fraunhofer-Institut für Siliziumtechnologie (ISIT) entwickelten Akkumulator, der in seiner Energiedichte, Druckresistenz und ungewöhnlichen Formgebung (sechseckig) für den Einsatz in einem Autonomen Unterwasserfahrzeug (AUV) optimiert wurde.[50][51]
Weitere Akkumulatortypen[Bearbeiten | Quelltext bearbeiten]
Beim Dual-Carbon-Akkumulator bestehen beide Elektroden, sowohl die Kathode als auch die Anode, aus porösem Graphit. Dieser Akkumulatortyp befindet sich im Forschungsstadium und hat mit Stand 2019 noch keine wirtschaftliche Bedeutung. Er gehört nicht zu den Lithiumionenzellen im engeren Sinn, weil beim Entladen nicht wie üblich an der Pluspolseite Li+-Ionen eingelagert werden.
Bauformen[Bearbeiten | Quelltext bearbeiten]


Handelsübliche Einzelzellen von Lithium-Ionen-Akkumulatoren werden üblicherweise in zylindrischer Bauform, als mit speziellem Gehäuse konfektionierte Einzelzellen (prismatische Zelle) oder als Pouch-Zellen ausgeführt. Die zylindrische Bauform ist dabei mit einer fünfstelligen Zahl gekennzeichnet und ermöglicht so einen einfachen Austausch. Die ersten beiden Ziffern geben den Zelldurchmesser in Millimeter an, die dritte und vierte Stelle die Länge der Zelle in Millimeter. Diese Baugrößen sind nicht genormt und die Abmessungen weichen von Hersteller zu Hersteller nicht unerheblich von diesen Werten ab. In nachfolgender Tabelle sind beispielhaft einige übliche Zellgrößen mit den typischen Kapazitätswerten angegeben. Die konkreten Werte zu der Kapazität stellen grobe Richtwerte dar und sind vom konkreten Zelltyp und Hersteller abhängig.
| Zell- bezeich- nung |
Abmessungen (ø × l) (mm) |
Typische Kapazität (Ah) |
Bauform wie[52] |
Hinweis/Verwendung |
|---|---|---|---|---|
| 10180 | 10 × 18 | 0,3–0,4 | 2⁄5 AAA-Zelle | |
| 10280 | 10 × 28 | 0,3–0,4 | 2⁄3 AAA-Zelle | |
| 10440 | 10 × 44 | 0,3–0,4 | AAA-Zelle/R03 | |
| 13450 | 13 × 45 | 0,5–0,7 | Einsatz in E-Zigaretten | |
| 14250 | 14 × 25 | 0,25–0,3 | 1⁄2 AA-Zelle | |
| 14430 | 14 × 43 | 0,6–0,7 | 4⁄5 AA-Zelle | |
| 14500 | 14 × 53 | 0,7–0,8 | AA-Zelle/R6 | |
| 14650 | 14 × 65 | 0,9–1,6 | ||
| 16340 | 16 × 34 | 0,6–1,0 | CR123A | |
| 16500 | 16 × 50 | 0,8–1,2 | ||
| 16650 | 16 × 65 | 2–3 | ||
| 17500 | 17,3 × 50 | 0,7–1,2 | A-Zelle/R23 | |
| 17650 | 17 × 65 | 1,2–2,5 | ||
| 18350 | 18 × 35 | 0,7–1,2 | ||
| 18500 | 18,3 × 49,8 | 1,1–2,2 | ||
| 18650 | 18,6 × 65,2 | 0,8–3,5 | Weitverbreitet u. a. in Notebooks, Elektroautos, E-Zigaretten und Taschenlampen | |
| 21700 | 21 × 70 | 3–5[53] | auch als 2170 bezeichnet, Anwendung bislang überwiegend in Elektroautos und E-bikes[54][55] | |
| 22500 | 22,3 × 51,4 | 2,0–2,6 | Ersatz für 3×AAA-Pack in Taschenlampen | |
| 23430 | 23 × 43 | 3,3–5,2 | Sub-C-Zelle | |
| 25500 | 24,3 × 49,2 | 3,7–5 | ||
| 26500 | 26 × 50 | 2–4 | C-Zelle/R14 | |
| 26650 | 26,5 × 65,4 | 3,3–5,2 | Weitverbreitet u. a. in Elektroautos | |
| 32600 | 32 × 61,9 | 5,5–6 | D-Zelle/R20 | |
| 4680 | 46 × 80 | Tesla, in zukünftigen Elektroautos[56] | ||
| 4695 | 46 × 95 | BMW, in zukünftigen Elektroautos[57] | ||
| 46120 | 46 × 120 | BMW, in zukünftigen Elektroautos[57] |
Eigenschaften[Bearbeiten | Quelltext bearbeiten]

Da Lithium-Ionen-Akkumulator der Oberbegriff für eine Vielzahl an möglichen Kombinationen von Materialien für Anode, Kathode und Separator darstellt, ist es schwierig, allgemeingültige Aussagen zu treffen. Je nach Materialkombination unterscheiden sich die Eigenschaften teilweise deutlich. Hinzu kommt die fortwährende Verbesserung durch die Akkuhersteller, die in den letzten Jahren insbesondere auf den bekannten Problemfeldern wie Haltbarkeit und Sicherheit erhebliche Verbesserungen erzielen konnten, während die spezifische Energie nur in vergleichsweise geringem Umfang erhöht wurde.[58]
Allen Lithium-Ionen-Akkumulatoren gemeinsam ist, dass die Zellen gasdicht versiegelt sein müssen und lageunabhängig betrieben werden können. Die spezifische Energie liegt in der Größenordnung von 150 Wh/kg und die Energiedichte in der Größenordnung von 400 Wh/l, womit Lithium-Ionen-Akkumulatoren insbesondere im Bereich mobiler Anwendungen als elektrischer Energiespeicher interessant sind und den Aufbau kleiner und leichter Akkumulatoren erlauben.[59] Die temperaturabhängige Selbstentladungsrate liegt im Bereich von nahe 0 % bis 8 % pro Monat, der typische Temperaturbereich für den Einsatz liegt bei ca. −30 °C bis +60 °C.
Wirkungsgrad[Bearbeiten | Quelltext bearbeiten]
- Coulomb-Wirkungsgrad
- Der Coulomb-Wirkungsgrad bzw. die Coulomb-Effizienz beträgt typischerweise annähernd 100 %,[60] das heißt, fast die gesamte in den Akkumulator geflossene Ladung kann diesem auch wieder entnommen werden. Nur während der ersten Zyklen ist die Coulomb-Effizienz geringer, da ein Teil der Lithiumionen mit der Elektrolytlösung an der Anode und Kathode irreversibel unter Ausbildung von Deckschichten reagiert.[61]
- Speichervermögen in Abhängigkeit vom Entladestrom
- Das Speichervermögen in Abhängigkeit vom Entladestrom kann durch die Peukert-Gleichung näherungsweise beschrieben werden. Je höher der Entladestrom, desto weniger elektrische Energie kann dem Akku entnommen werden. Für Lithium-Ionen-Akkus liegt die Peukert-Zahl bei ca. 1,05.
- Energie-Effizienz
- Es kommt – wie bei jedem Akkumulator – zu Energieverlusten durch den Innenwiderstand sowohl beim Laden als auch beim Entladen. Typische Gesamtwirkungsgrade früher Lithium-Cobaltdioxid-Akkumulatoren (vor 2006) betrugen um die 90 %[60], Stand 2012 werden 90 % bis 95 %[62] angegeben. Werden im Verhältnis zur maximalen Strombelastbarkeit des Akkumulators kleine Lade- und Entladeströme verwendet, können auch über 98 % erreicht werden.
Spezifische Energie und Energiedichte[Bearbeiten | Quelltext bearbeiten]
Die massenbezogene spezifische Energie ist mehr als doppelt so hoch wie beispielsweise die des Nickel-Cadmium-Akkumulators und liegt bei 0,09–0,25 kWh/kg, die volumenbezogene Energiedichte liegt bei 0,2–0,5 kWh/l, je nach verwendeten Materialien.[63] Anwendungen, die eine besonders lange Lebensdauer benötigen, beispielsweise für den Einsatz in Elektroautos, laden und entladen den Lithium-Ionen-Akku oft nur teilweise (z. B. von 30 bis 80 % statt von 0 bis 100 %), was die Zahl der möglichen Lade-Entlade-Zyklen überproportional erhöht, aber die nutzbare Energiedichte entsprechend reduziert.[64]
Spannung[Bearbeiten | Quelltext bearbeiten]
| Material | Spannung |
|---|---|
| LiCoO2 | 3,6 V |
| LiMnO2 | 3,7–3,8 V |
| LiFePO4 | 3,2-3,3 V |
| Li2FePO4F | 3,6 V |
Ein konventioneller LiCoO2-Akku liefert eine Nennspannung von 3,6 Volt, die damit rund dreimal so hoch wie die eines Nickel-Metallhydrid-Akkumulators (NiMH-Akku) ist. Die Ladeschlussspannung liegt bei bis zu 4,3 Volt. Die Entladeschlussspannung beträgt 2,5 Volt; eine Tiefentladung führt zu irreversibler Schädigung und Kapazitätsverlust. Die Zellspannung hängt jedoch vom verwendeten Kathodenmaterial ab und ist daher von Akkutyp zu Akkutyp leicht unterschiedlich.[64]
Ladevorgang[Bearbeiten | Quelltext bearbeiten]
Batteriemanagementsystem[Bearbeiten | Quelltext bearbeiten]

Ein weiteres Merkmal aller Lithium-Ionen-Akkumulatoren ist, dass die Zellen von der Zellchemie her nicht imstande sind, Überladungen zu verkraften[65], weshalb dieser Akkutyp über lange Zeit nicht eingesetzt wurde, obwohl er bereits in den 1980er Jahren entwickelt worden war.[66] Da integrierte Schaltkreise sehr preisgünstig geworden sind, können Lithium-Ionen-Akkus heute in Verbindung mit einem Batteriemanagementsystem (Elektronische Schaltung, BMS) betrieben werden, was die Sicherheit im Umgang mit diesem Akkutyp erheblich erhöht hat. Bei Akku-Packs kleiner und mittlerer Baugröße ist diese Elektronik meist integriert. Spezielle Laderegler dienen dem Schutz gegen Tiefentladung und Überladung. Die Elektronik steuert den ladungsabhängigen Ladestrom und überwacht insbesondere die exakt einzuhaltende Ladeschlussspannung. Eine selbstrückstellende Sicherung verhindert Überstrom beziehungsweise Kurzschluss. Die verwendete Prozessorsteuerung ist auf die Eigenschaften des jeweiligen Akkutyps abgestimmt. Akku-Packs, in denen zur Spannungserhöhung mehrere Zellen in Reihe geschaltet werden, verfügen oft zusätzlich über eine Elektronik, die durch sog. „Cell-Balancing“ den Ladezustand aller Zellen in einem Pack aneinander angleicht.[67][68] Insbesondere muss die Ladung beendet oder der Ladestrom reduziert werden, wenn die erste Zelle die Maximalspannung überschreitet. Ebenso ist die Entladung zu beenden, wenn die erste Zelle die Minimalspannung unterschreitet. Bei der Integration einer solchen Überwachungselektronik in die Zelle vergrößern sich die Abmessungen der Akkumulatoren allerdings etwas, was im Falle von standardisierten Lithium-Ionen-Zellen wie der 18650 dazu führt, dass diese nicht mehr in handelsübliche Fassungen eingesetzt werden können, da sich die Länge um 3 bis 4 mm erhöht.
Ladeverfahren[Bearbeiten | Quelltext bearbeiten]
Da Lithium-Ionen-Akkus keinen Memory-Effekt haben und auch nicht formiert werden müssen, werden sie immer auf die gleiche Art geladen: Bei den meisten handelsüblichen Akkus wird das CC-CV-Ladeverfahren (constant current–constant voltage charging) angewandt. Dabei wird der Akku solange mit einem konstanten Strom geladen, bis die Ladeschlussspannung erreicht wird. Die Ladeschlussspannung ist abhängig von der Nennspannung des jeweiligen Akkutyps.[69] Der Ladestrom sinkt dann mit der Zeit immer weiter ab, je voller der Akkumulator wird. Sobald der Strom einen bestimmten Wert (z. B. C/10 oder gar nur 3 Prozent des anfänglichen Stroms) unterschreitet oder er über einen längeren Zeitraum nicht mehr sinkt, wird die Ladung beendet.[64] Die Höhe des Ladestromes wird je nach Akkutyp nach dem C-Faktor bemessen.[70] Die Ladeschlussspannung von produktabhängig 3,6 V (LiFePO4) bis 4,3 V (LiMnO2) darf allenfalls mit einer geringen Toleranz (z. B. 50 mV) überschritten werden. Die Verwendung einer etwas niedrigeren Ladeschlussspannung ist hingegen unkritisch. Einer gewissen Verringerung der Kapazität steht meist eine deutliche Erhöhung der Zahl der nutzbaren Lade-Entlade-Zyklen gegenüber.
Ladezustandsanzeige in Smartphones[Bearbeiten | Quelltext bearbeiten]
Mobiltelefone stellen den Ladezustand der enthaltenen Li-Ion-Batterie oft als Prozentangabe dar. Diese Angabe kann allerdings nur als Schätzung angesehen werden, da sie sich in der Regel an der gemessenen Batteriespannung orientiert, welche während der Entladung der Batterie abfällt. Der Zusammenhang zwischen Spannung und noch in der Batterie enthaltenen Energie ist jedoch nicht linear und stellt nur eine Annäherung dar.[71]
Überladung[Bearbeiten | Quelltext bearbeiten]
Droht eine Überladung, trennt die Überwachungselektronik die Zelle von der Stromquelle, bis die Elektronik eine Spannungsreduktion erkennt. Nicht alle auf dem Markt erhältlichen Akkus besitzen eine integrierte Überwachungselektronik. Bei Überladung einiger Typen von Lithium-Ionen-Akkus kann metallisches Lithium an der Kathode (Elektrolyse) reduziert werden und sich ablagern oder es wird Sauerstoff aus der Anode (Elektrolyse) freigesetzt. Letzterer gast bestenfalls durch ein Sicherheitsventil aus oder reagiert mit Elektrolyt oder Anode. Dabei heizt sich der Akkumulator auf und kann sogar in Brand geraten.[64] Andere Lithium-Ionen-Akkus wie der LiFePO4-Akku sind thermisch stabil, werden aber bei Überladung ebenfalls irreversibel geschädigt.
Entladung[Bearbeiten | Quelltext bearbeiten]
Die Spannung des Lithium-Ionen-Akkus sinkt während der Entladung zunächst recht schnell von der erreichten Ladeschlussspannung auf die Nennspannung (ca. 3,6 bis 3,7 V) ab, sinkt dann aber während eines langen Zeitraums kaum weiter ab. Erst kurz vor der vollständigen Entladung beginnt die Zellspannung wieder stark zu sinken.[72] Die Entladeschlussspannung beträgt je nach Zellentyp um die 2,5 V; diese darf nicht unterschritten werden, sonst wird die Zelle durch irreversible chemische Vorgänge zerstört. Viele Elektronikgeräte schalten aber schon bei deutlich höheren Spannungen, z. B. 3,0 V, ab.
Es ist empfehlenswert, Lithium-Ionen-Akkus „flach“ zu (ent-)laden, da sich deren Lebensdauer so verlängert. Wenn ein Lithium-Ionen-Akku immer von 100 % Ladezustand auf 0 % entladen wird, bevor er wieder geladen wird, erreicht er nur die minimale Zyklenzahl. Besser ist es, je nach Typ, z. B. 70 % Entladetiefe anzuwenden. Dies bedeutet, dass der Akku noch 30 % Restkapazität enthält, wenn er wieder geladen wird. Einige Hersteller geben die Zyklenlebensdauer in Abhängigkeit vom Entladungsgrad an.[73]
Generell gilt, dass hohe Entladeströme sowohl die Nennkapazität eines Akkus senken, da dank des höheren Spannungsabfalls am Innenwiderstand die Entladeschlussspannung früher erreicht wird, als auch die Zyklenzahl aufgrund der höheren mechanischen und thermischen Belastung reduzieren. In früheren Veröffentlichungen wird noch auf einen optimalen Entladestrom von 0,2 C (das heißt einem Entladestrom in Höhe von einem Fünftel des Nominalwerts der Nennkapazität in Ah) hingewiesen. Bei einem Akku mit einer Kapazität von 5 Ah wären dies 1 A.[74]
Tiefentladung[Bearbeiten | Quelltext bearbeiten]
Zur Verhinderung einer Tiefentladung von Zellen schaltet das Batteriemanagement den Akku temporär ab. Im Falle einer integrierten Schutzelektronik kann dann an den Kontakten des Akkupacks keine Spannung mehr gemessen werden. Der Akku wird von der Schutzelektronik erst wieder an die Kontakte geschaltet, wenn eine äußere (Lade)Spannung anliegt. Ladegeräte, welche die Ladespannung erst freigeben, wenn sie erkennen, dass ein Akku angeschlossen wurde, laden solche Akkus unter Umständen nicht auf.
Tiefentladung führt meist zu irreversibler Schädigung und Kapazitätsverlust. Wenn eine Zelle auf unter 1,5 V entladen wurde, sollte sie nicht mehr verwendet werden, da sich dann mit einiger Wahrscheinlichkeit Brücken ausgebildet haben, die zu einem Kurzschluss führen.
Selbstentladung[Bearbeiten | Quelltext bearbeiten]
Lithium-Ionen-Akku altern schneller bei höherem Ladezustand und höheren Temperaturen. Vorteilhaft, aber in der Praxis unrealistisch, wäre ein nur wenig geladener, kühl gelagerter, regelmäßig kontrollierter Akku, der vor Benutzung geladen und nach Benutzung gegebenenfalls teilweise wieder zu entladen wäre. Mit viel Aufwand und im entscheidenden Augenblick vielleicht leeren Akku könnte man die Lebensdauer verlängern. Wichtig ist es allerdings, selten genutzte Akkus alle 18 bis 24 Monate auf den Ladezustand zu kontrollieren und nachzuladen, um Tiefentladungen zu verhindern.
Ältere Quellen nennen eine Selbstentladung bei 5 °C von etwa 1 bis 2 %/Monat, bei 20 °C etwa 30 %/Monat.[75] Aktuelle Angaben geben eine Selbstentladung von 3 %/Monat auch bei Zimmertemperatur an.[73] Ein Akku sollte etwa alle sechs Monate auf 55 bis 75 % nachgeladen werden. Lithium-Ionen-Akkumulatoren dürfen sich auch bei Lagerung nicht unter 2,7 V pro Zelle entladen. Eventuell flüssige oder gelförmige Elektrolyte in der Zelle dürfen nicht gefrieren, was einer Mindesttemperatur um −25 °C entspricht. Die Ursache der Selbstentladung kommt durch DMT, welches aus den PET Klebebändern entweicht – neuere Generationen werden dieses Problem nicht mehr haben.[76][77]
Lagerung[Bearbeiten | Quelltext bearbeiten]
Lithiumbatterien auf Basis von Lithium-Cobalt(III)-oxid können thermisch durchgehen, z. B. beim Laden und nach Beschädigung. Aus Brandschutzsicht ist daher eine Lagerung der Lithiumbatterien im Freien, aber geschützt vor direkter Sonne, vorteilhaft. Widerstandsfähige Stahlbehälter oder Brandschutzschränke können eine Kettenreaktion verhindern und sind ein Schutz vor Funken, Flammen, Hitze und Projektilen (Splitter aus einer Explosion einer Batterie). Um einen Überdruck durch Rauchgas und eine Explosion des Behältnisses zu verhindern, muss er eine Druckentlastungsöffnung besitzen, welche die Rauchgase ableitet, am besten ins Freie; selten auch Gasmanagement genannt.[78] Optimalerweise verfügt das Behältnis über einen Rauchmelder.
Zum Löschen ist Metallbrandpulver, Sand, oder Löschgas weniger geeignet. Besser sind größere Mengen Wasser auch mit Schaummittel. Dessen Kühlwirkung kann das Durchgehen weiterer Zellen und Module verhindern.[79]
Für den Menschen sind bei Bränden die hohen Konzentrationen Salzsäuregas und Flusssäuregas gefährlich, in einer Studie des KIT wurde der IDLH um Faktor 4,5 bzw. Faktor 2 überschritten.[79]
Lebensdauer[Bearbeiten | Quelltext bearbeiten]
Lithium-Ionen-Akkus altern sowohl durch Benutzung, eine vollständige Ladung und Entladung wird als Zyklus bezeichnet, als auch einfach mit der Zeit (kalendarische Lebensdauer). Die Alterung reduziert die Kapazität und erhöht den Innenwiderstand.[80]
Die Altersmechanismen werden von der Forschung zunehmend verstanden, wenn auch die Überlagerung der verschiedenen Mechanismen nicht trivial ist.[80][81][82]
Kalendarische Lebensdauer[Bearbeiten | Quelltext bearbeiten]
Insbesondere die erste Generation der in Endverbrauchergeräten verbauten Lithium-Ionen-Akkus hatte nur eine kurze Lebensdauer. Teilweise war nach nur einem Jahr ein erheblicher Kapazitätsverluste festzustellen; nach zwei bis drei Jahren war mancher Akku bereits unbrauchbar. Der schleichende Kapazitätsverlust hing weniger von der Zahl der Lade-Entlade-Zyklen, sondern vor allem von den Lagerbedingungen ab: Je höher die Temperatur und je voller der Akku, desto eher kam es zum Ausfall. Als Grund hierfür werden in der Regel parasitäre unumkehrbare chemische Reaktionen genannt.[83]
Bei aktuellen Lithium-Ionen-Akkus liegt die kalendarische Lebensdauer deutlich höher, so dass inzwischen meist die erreichbare Zahl der Lade-/Entladezyklen entscheidet, wie lange der Akku verwendet werden kann.
Ladezyklen[Bearbeiten | Quelltext bearbeiten]
Die erreichbare Zahl der Lade-/Entladezyklen ist abhängig von Art und Qualität des Akkus, von der Temperatur und von der Art der Nutzung des Akkus, insbesondere (Ent-)Ladehub, Ladeschlussspannung und Stärke der Lade- sowie Entladeströme. Bei hohen Temperaturen verringert sich die Zyklenhaltbarkeit drastisch, weshalb der Akku am besten bei Raumtemperatur verwendet werden sollte. Niedrige Temperaturen während des Betriebs, nicht jedoch während der Lagerung, sind ebenfalls schädlich.
Durch flaches Laden und Entladen wird die Haltbarkeit stark überproportional verbessert, das heißt, dass ein Lithium-Ionen-Akku, der nur von 75 % bis 25 % genutzt wird, etwa die vier- bis achtfache Zyklenzahl durchhält, als wenn er von 100 % bis 0 % genutzt wird. Der Akku hält also das doppelte bis vierfache an äquivalenten Vollzyklen.[81] Der Grund hierfür ist, dass bei vollständig entladenem und vollständig geladenem Akku hohe Belastungen für die Elektroden entstehen. Optimalerweise werden bei solchen seicht zyklisierten Akkus sowohl die Ladeschlussspannung reduziert als auch die Entladeschlussspannung erhöht. Ebenso erhöhen starke Lade- und Entladeströme die mechanischen und thermischen Belastungen und wirken sich so negativ auf die Zyklenzahl aus.[84]
Zunehmend werden jedoch auch im Endverbraucherbereich bessere Lithium-Ionen-Akkus mit längerer Haltbarkeit verkauft.
Apple gab im Juni 2009 an, die in den neuen Modellen der MacBook-Pro-Familie verbauten Akkus seien bis zu 1.000 Mal wiederaufladbar, bevor sie nur noch 80 % ihrer ursprünglichen Kapazität erreichten. Das soll einer Verdreifachung der Lebensdauer gegenüber den herkömmlichen Akkus entsprechen.[85] Bei Beachtung der von den schlechten Akkus der ersten Generationen (meist LiCoO2-Akkus) gelernten Anwendungsregeln – Betrieb und Lagerung bei möglichst tiefer Temperatur; Lagerung nur im teilgeladenen Zustand; generell weder ganz geladen noch ganz entladen – könnte die mit den neueren Akkus erzielbare Zyklenzahl auch höher ausfallen. Ein Community-Portal zur Akku-Lebensdauer von Laptop-Akkus nennt bei einer Fallzahl von 1.644 eine durchschnittliche Zyklenzahl von 424 bei 82 % Restkapazität, wobei auch Fälle von 60 % Verlust nach nur 120 Zyklen nicht selten seien.[86]
Bei E-Bike-Batterien zweier namhafter Hersteller konnte der ADAC bei einem Test 2015 nach 500 Voll-Ladezyklen noch mindestens 80 % der ursprünglichen Kapazität bestätigen.[87]
Bei Elektrofahrzeugen wurden 2009 mindestens 1.000 bis etwa 3.000 Lade- und Entladezyklen angegeben und 1.000[88] bis 1.750 Zyklen (2020) nachgewiesen.[89] Ende 2019 geht man von 2.000 Zyklen aus.[90]
Stand 2020 werden industrielle Akkus mit einer Lebensdauer von 11.000 Zyklen und 15 Jahren kalendarischen Lebensdauer bei Erhaltungsladung angeboten, bei einer Restkapazität von 90 %.
Betriebs- und Umgebungstemperatur[Bearbeiten | Quelltext bearbeiten]
Da bei Kälte die chemischen Prozesse (auch die Zersetzung des Akkumulators bei der Alterung) langsamer ablaufen und die Viskosität der in Li-Zellen verwendeten Elektrolyte stark zunimmt, erhöht sich auch beim Lithium-Ionen-Akku bei Kälte der Innenwiderstand, wodurch die entnehmbare Leistung sinkt. Zudem können die verwendeten Elektrolyte bei Temperaturen ab −25 °C einfrieren. Manche Hersteller geben den Arbeitsbereich mit 0–40 °C an. Optimal sind für viele Zellen 18–25 °C. Unter 10 °C kann bei manchen Typen durch den erhöhten Innenwiderstand die Leistung so stark nachlassen, dass ein Gerät mit höherem Strombedarf nur noch einige Minuten betrieben werden kann.[91] Es gibt Lithium-Ionen-Akkus mit speziellen Elektrolyten, die bis −54 °C eingesetzt werden können.[91] Durch das Laden bei niedrigen Temperaturen tritt meist eine starke Alterung auf, die mit irreversiblem Kapazitätsverlust einhergeht.[92] Aus diesem Grund wird für die meisten Akkus 0 °C als untere zulässige Temperatur während des Ladevorgangs angegeben.
Bei zu hohen Betriebstemperaturen bildet sich bei vielen Systemen durch Zersetzung des Elektrolyts eine Schicht auf der Anode, die den Zellinnenwiderstand erhöht. Die Temperatur während des Entladevorgangs wird von den meisten Herstellern deshalb auf 60 °C limitiert. Lithium-Ionen-Akkumulatoren erwärmen sich während des Entladevorgangs, besonders bei hohen Strömen. Die maximale Temperatur hängt dabei in vielen Fällen linear von der Entladerate ab.[93][94]
Preis[Bearbeiten | Quelltext bearbeiten]

Die Kosten von Lithium-Ionen-Akkus gehen stetig zurück. Eine weitere Kostensenkung wird sowohl aufgrund von technischen Fortschritten als auch der Erhöhung der Produktionskapazitäten erwartet.[97] Zwischen 1991, als Lithium-Ionen-Akkus in den Markt eingeführt wurden, und 2018 fielen die Zellpreise um 97 %. Der Rückgang betrug im Zeitraum 1992 bis 2016 durchschnittlich 13 % pro Jahr.[98] Zwischen 2010 und 2020 fielen die Kosten von 1100 Dollar/kWh auf durchschnittlich 137 Dollar/kWh; dies ist eine Preisreduktion um 89 %. Erstmals wurden zudem bei einzelnen Akkupacks für chinesische E-Busse Preise von unter 100 Dollar/kWh erzielt. Die Marke von 100 Dollar/kWh wird per Faustformel als etwa die Schwelle angesehen, bei denen Fahrzeughersteller E-Autos zum gleichen Preis und mit gleicher Marge wie herkömmliche Fahrzeuge mit Verbrennungsmotor verkaufen können. Erwartet wird, dass diese Preise im Durchschnitt im Jahr 2023 erreicht sein werden.[99]
Eine Studie des US-Energieministeriums vom Februar 2017 weist darauf hin, dass die Kosten der Traktionsbatterie, samt Kapselung, Gehäuse, Elektronik und Temperatur-Management, dem Preis der Zellen nur verzögert folgen.[100]

Gefahren beim Umgang mit Lithium-Ionen-Akkus[Bearbeiten | Quelltext bearbeiten]
Transport[Bearbeiten | Quelltext bearbeiten]

Für die Beförderung von Lithium-Akkumulatoren/-Batterien gelten auf Grund der hohen Brandgefahr bei Kurzschluss oder Wasser-Einfluss besondere Sicherheitsvorschriften:
- Einstufung aller Lithium-Batterien seit dem 1. Januar 2009 als Gefahrgut der Klasse 9.[101] Um sie versenden zu dürfen, muss, in der Regel durch den Zell- bzw. Batteriehersteller, zunächst der UN-Transport-Test UN/DOT 38.3[102] (englisch UN Transportation Testing) von einem akkreditierten Prüflabor durchgeführt werden. Hierbei handelt es sich um insgesamt acht Tests. Dieser Test ist zu dokumentieren, ab 2019 (verpflichtend ab 2020) erfolgt dies in einem inhaltlich/ formal vorgegebenen Testbericht (test report).
- für den Straßentransport: das „Europäische Übereinkommen über die internationale Beförderung gefährlicher Güter auf der Straße“ (ADR). Die Übergangsvorschrift gem. 1.6.1.20 ADR findet Anwendung.
- für den Seetransport: der International Maritime Dangerous Goods Code
- für den Lufttransport: die ICAO Technical Instructions (ICAO T.I.) bzw. die IATA Dangerous Goods Regulations (IATA DGR)
- das Gesetz über die Beförderung gefährlicher Güter (GGBefG, Deutschland)
- die „Gefahrgutverordnung Straße, Eisenbahn und Binnenschifffahrt“ (GGVSEB, Deutschland)
- Viele Paketdienste, Fluggesellschaften und Flughäfen haben zusätzlich eigene Beförderungsbestimmungen für Lithium-Ionen-Akkus, wobei kleinere Akkus (ca. < 100 Wh) meist unproblematisch sind. Für den DHL-Versand von Artikeln, die Lithium-Ionen-Akkumulatoren oder Batterien enthalten, gilt z. B. eine Regelung für die Beförderung von gefährlichen Stoffen und Gegenständen.[103]
Grundsätzlich unterscheiden die Gefahrgutvorschriften zwischen „kleinen“ und „großen“ Lithiumbatterien. Klein bedeutet dabei bei Lithium-Ionen-Batterien eine max. Nennenergie von 20 Wh je Zelle bzw. 100 Wh je Batterie. Bei Lithium-Metall-Batterien gelten Zellen bis 1 g Lithiumgehalt bzw. Batterien bis 2 g Lithiumgehalt als klein. Kleine Zellen/ Batterien unterliegen, entweder einzeln, in oder mit Geräten (Verbrauchern) befördert, erleichterten Bedingungen, während große Zellen/ Batterien gefahrgutrechtlich umfangreicheren Transportbedingungen unterliegen[104]. Die Erleichterungen für kleine Zellen/ Batterien sind im Straßen-, See- und Lufttransport weitestgehend gleich, wobei es für den Lufttransport strengere Anforderungen bzgl. der im Paket zulässigen Batteriemenge gibt. Grundlage ist die Sondervorschrift SV 188 ADR/ IMDG-Code bzw. die entsprechenden Verpackungsanweisungen (packing instructions) PI 965 – PI 970, jeweils Section II. Darüber hinaus wird beim Versand zusätzlich zwischen intakten, (potenziell) defekten / beschädigten Akkus, sowie Akku-Prototypen unterschieden, für die es jeweils abweichende Vorgaben gibt.[105]
Der Versand von Paketen mit kleinen Zellen/ Batterien erfolgt in der Regel mit einer deutlich sichtbaren Kennzeichnung, welche auf den Inhalt hinweist. Sofern es sich um eingebaute Knopfzellen handelt, ist diese Kennzeichnung nicht vorgeschrieben. Ebenfalls ohne Kennzeichnung dürfen Pakete versendet werden, die max. 2 in Geräten eingesetzte kleine Lithiumbatterien enthalten, sofern die Sendung aus nicht mehr als 2 solchen Paketen besteht.
Der Aufkleber enthält Hinweise über/darüber[106]
- das Vorhandensein von Lithium-Ionen-Zellen bzw. Batterien, erkennbar an der aufgeführten UN-Nummer
- dass bei Beschädigung Entzündungsgefahr besteht,
- eine Telefonnummer, bei der man zusätzliche Informationen erhalten kann.
Auch für Lithiumbatterien im Passagiergepäck von Flugreisenden gibt es detaillierte Regelungen, so dürfen beispielsweise einzelne Lithiumbatterien ohne Gerät/ Verbraucher wie Powerbanks oder Ersatzbatterien nicht im aufgegebenen Gepäck transportiert werden, sondern müssen zwingend im Handgepäck mitgeführt werden. Fluggesellschaften sind verpflichtet, ihre Passagiere auf die entsprechenden Regelungen zu Gefahrgut im Gepäck durch Aushänge, Fragen beim Check-In oder deutliche Hinweise beim Check-In im Internet hinzuweisen. Auch die nationalen Luftfahrtbehörden wie das deutsche LBA haben die Bestimmungen dazu veröffentlicht.[107]
Mechanische Belastung[Bearbeiten | Quelltext bearbeiten]
Mechanische Beschädigungen wie in die Akkuzelle eindringende Objekte oder ein Herunterfallen können zu inneren elektrischen Kurzschlüssen führen. Dadurch fließen hohe Ströme, die zur Erhitzung des Akkumulators führen. Dabei können Gehäuse aus Kunststoff schmelzen und entflammen. Unter Umständen ist ein mechanischer Defekt von außen nicht unmittelbar zu erkennen. Auch längere Zeit nach dem mechanischen Defekt kann es noch zum inneren Kurzschluss kommen. Ebenso kann durch äußere Beschädigung Luft und insbesondere Luftfeuchtigkeit in die Zelle eindringen und unerwünschte chemische Reaktionen hervorrufen.
Chemische Reaktionen[Bearbeiten | Quelltext bearbeiten]
Dendritenbildung[Bearbeiten | Quelltext bearbeiten]
Zur Ursache und Vermeidung von Dendritenbildungen wird intensiv geforscht. Bei dem Vorgang lagert sich Lithium, welches beim Entladen des Akkumulators in Lösung ging, beim erneuten Ladevorgang nicht wieder an derselben Stelle ab und bildet stattsdessen Dendrite. Diese durchsetzen den Separator, können diesen später auch durchdringen und somit Kurzschlüsse verursachen. Als Ursache für die Dendritenbildung wird von einigen Forschergruppen die Zusammensetzung der Oberflächenschicht auf der negativen Elektrode und des Elektrolyten angenommen. Experimentelle Forschungsergebnisse aus dem Helmholtz-Institut Ulm zeigen jedoch in eine andere Richtung: eine dem Metall innewohnende Eigenschaft bedingt die astartigen Auswüchse. Die Forscher meinen die so genannten Selbstdiffusionsbarrieren verschiedener Metalle, die in Akkus verwendet werden, als Basis identifiziert zu haben. Diese Barrieren sind ausschlaggebend für die Gleichmäßigkeit, mit der sich die Metallatome beim Wiederaufladen der Batterie nach der Abscheidung auf der Anodenoberfläche verteilen.[108][109]
Übertemperatur[Bearbeiten | Quelltext bearbeiten]

Die meisten Lithium-Ionen-Akkumulatorentypen werden durch Übertemperatur beschädigt, da es bei einigen der häufig eingesetzten Oxide wie Lithium-Cobalt(III)-oxid und Mischoxiden wie Lithium-Nickel-Mangan-Cobalt-Oxiden ab Temperaturen von ca. 180 °C zu einem thermischen Durchgehen kommt, bei dem die im Akku gespeicherte Energie in kürzester Zeit durch direkte chemische Reaktion in Form von Wärme frei wird. Viele BMS, wie z. B. in 18 V-Werkzeugakkus von Makita, verfügen daher über eine Temperatursicherung. Oxide wie Nickeldioxid, welche zwar den Bau von Lithium-Ionen-Akkumulatoren mit vergleichsweise hoher spezifischer Kapazität erlauben, neigen stark zu thermischem Durchgehen und werden daher in kommerziellen Anwendungen praktisch nicht verwendet.[110] Beim thermischen Durchgehen wird durch den chemischen Zerfall des Oxids im Akkumulator Sauerstoff freigesetzt, welcher chemisch mit Zellbestandteilen wie dem Elektrolyten reagiert und so zu einer sich selbst steigernden, von außen nicht mehr anhaltbaren exothermen Reaktion und thermischer Zerstörung des Akkumulators führt. Dies gilt für alle bekannten Kathodenmaterialien, auch für Lithiumeisenphosphat.[111] Die Kathodenmaterialien unterscheiden sich allerdings in der Onset-Temperatur (bei der die exotherme Reaktion beginnt) und hinsichtlich der dabei freigesetzten Energie.
Um einen klassischen Metallbrand handelt es sich hier nicht, da die Gesamtmenge an „metallischem“ (in Graphit intercaliertem) Lithium auch im geladenen Zustand nicht sehr groß ist, und durch die kompakte Bauform intern mit dem Metalloxid abreagiert. Gewöhnliche Löschmittel (Schaum, Kohlensäure, bes. Wasser durch die Kühlwirkung) sind daher wirksam und können gefahrlos verwendet werden.[112] Die mögliche Brandgefahr kann zu kostspieligen Rückrufaktionen der Hersteller führen.[113]
Abhilfe[Bearbeiten | Quelltext bearbeiten]
Keramische, temperaturbeständigere Separatoren gewähren eine erhöhte Sicherheit. Ebenso können Zellchemikalien eingesetzt werden, die thermisch stabiler sind oder deren Zersetzung nicht exotherm abläuft. Beispielsweise können statt kostengünstiger Lithium-Cobaltdioxid-Akkumulatoren betriebssichere Lithium-Eisenphosphat-Akkumulatoren eingesetzt werden: Diese weisen allerdings neben einem höheren Preis auch eine geringere Energiedichte auf und erlauben keine derart kompakten Bauformen wie Lithium-Cobaltdioxid-Akkumulatoren.
Weitere unmittelbar in die Zelle integrierte Schutzmaßnahmen betreffen die elektrische Verbindung zwischen dem Elektrodenmaterial und dem äußeren Zellanschluss. Die Verbindung kann so ausgeführt werden, dass sie wie eine Schmelzsicherung wirkt und zusätzlich beim Öffnen etwaiger Berstöffnungen abgerissen wird. Diese zellinternen Schutzmechanismen sind jedoch in der Regel irreversibel ausgeführt. Außer den zellinternen Schutzvorrichtungen gibt es innerhalb moderner Batterien meist weitere elektronische Schutzschaltungen. Deren Funktionen reichen von komplexen Batteriemanagementsystemen (BMS) mit Temperatursensoren, Ladeelektronik, Batteriezustandsüberwachung und externen Kommunikationsanschlüssen (smart batteries) bis zu einfachen, zumeist reversibel wirkenden Sicherheitsschaltungen, die lediglich die Überladung oder Überlastung der Batterie verhindern sollen.
In arbeitswissenschaftlichen Untersuchungen wurde festgestellt, dass der Umgang mit leistungsstarken Lithium-Ionen-Akkumulatoren wie deren Fertigung, Einbau, Lagerung, Entsorgung sowie bestimmte Betriebszustände nur geringe Auswirkungen auf den Arbeitsschutz hat. Die Gefahren wie bei Arbeiten mit höheren elektrischen Spannungen und die Handhabung von Gefahrstoffen der eingesetzten Zellchemie können durch Anpassung und konsequente Umsetzung bestehender Sicherheitsanforderungen minimiert werden.[114]
Beispiele von Vorfällen[Bearbeiten | Quelltext bearbeiten]
Im Automobilbau kommt es durch besonders hohe Sicherheitsanforderungen auf Grund der hohen installierten Energiemengen teilweise zu Verzögerungen beim Einsatz. So verschob Opel die Auslieferung des Ampera, als drei Wochen nach einem Crashtest eines baugleichen Chevrolet Volt der versuchsweise nicht ausgebaute, voll geladene Akku überhitzte und zum Fahrzeugbrand führte.[115] Daraufhin wurde das Sicherheitskonzept der Traktionsbatterie überarbeitet.[116]
Der Umgang mit brennenden Elektroautos stellt Pannendienste und Feuerwehren vor neue Herausforderungen, da z. B. für die Löschung wesentlich mehr Wasser benötigt wird. Zudem ist ein spezieller Kühlcontainer für den Abtransport erforderlich.[117][118][119][120] Ähnlich sieht es bei E-Bikes aus.[121]
Umweltauswirkungen[Bearbeiten | Quelltext bearbeiten]
CO2-Bilanz[Bearbeiten | Quelltext bearbeiten]
Bei der Herstellung der Akkumulatoren entsteht Kohlenstoffdioxid. Während frühere Studien zum Ergebnis kamen, dass pro installierter Kilowattstunde Energiespeicherleistung etwa 70 kg Kohlenstoffdioxid freigesetzt werden[122][123][124], kam eine im Jahr 2017 erschienene Überblicksstudie über den aktuellen Forschungsstand auf einen Mittelwert von ca. 110 kg pro installierter kWh.[125] Eine 2019 erschienene Überblicksarbeit bezifferte den CO2-Ausstoß bei der Herstellung des am häufigsten verwendeten NMC-Typs auf etwa 61 bis 106 kg CO2eq/kWh.[126]
Abhängig von verschiedenen Faktoren wie dem Strommix für die Batterieherstellung liegt die Spanne zwischen 38 und 356 kg CO2eq/kWh. Es existieren verschiedene Möglichkeiten, diese CO2-Emissionen zu reduzieren, beispielsweise durch die Senkung des Gesamtenergiebedarfs oder den Einsatz von Recyclingmaterialien. Als vermutlich erfolgversprechendste Maßnahme wird die Nutzung von Strom aus erneuerbaren Energien in der Akkuproduktion angesehen.[127]
Nach einer Studie im Auftrag der Europäischen Kommission können Elektrofahrzeuge bis 2050 fast CO2-frei sein – und zwar unter Berücksichtigung des gesamten Lebenswegs von der Herstellung über die Nutzung und das Recycling. Voraussetzungen dafür sind, dass der Strom, auch für die Fahrzeugherstellung, zu 100 % aus erneuerbaren Energien stammt und das vollständige Recycling der Batterien realisiert ist.[128] Ende 2020 erarbeitete die EU-Kommission eine verpflichtende Nachhaltigkeitsrichtlinie, wonach 35 % des Lithiums im Jahr 2026 und 70 % im Jahr 2030 recycelt werden müssen.[129] Bislang müssen 50 Prozent der Masse von Li-Akkus recycelt werden; dafür genügt mitunter die Rückführung des Gehäuses und der Leitungen nach Demontage der Batterie. Bei Haushalts-Batterien gilt ein Wert von mindestens 75 Prozent.[130][131] Mit aufwendigen Techniken lassen sich bis zu 96 % der Batteriebestandteile voneinander trennen,[132][133] doch ist bisher fraglich, ob sich die heutigen Verfahren ökonomisch und ökologisch rentieren (Stand 2020).[134]
Rohstoffgewinnung[Bearbeiten | Quelltext bearbeiten]
Die Umweltproblematiken von Lithium-Ionen-Batterien werden besonders mit Blick auf die Gewinnung von Lithium aus Salzsee-Solen in südamerikanischen Ländern (Chile, Argentinien) diskutiert.[135][136] Probleme, die sich aus der Li-Extraktion aus Salzseen ergeben, werden vor allem im Zusammenhang mit Wasserknappheit und daraus erwachsenden sozialen Konflikten thematisiert.[137] Seit etwa 2018 wurde Australien zum weltweit größten Lieferanten von Lithium, wobei Lithium im Festgestein-Bergbau produziert wird. Die beschriebenen Herausforderungen sind auch Motivation für das Recycling.[138]
Recycling[Bearbeiten | Quelltext bearbeiten]
Ein fachgerechtes Recycling ermöglicht die Verwertung der Batterien und damit die Rückgewinnung bestimmter Stoffe wie zum Beispiel Cobalt, Mangan, Nickel, Zink oder Kupfer.[139] Grundsätzlich gilt für die Entsorgung in Deutschland: Die Hersteller sind in der Pflicht, Altbatterien unentgeltlich zurückzunehmen (§ 5 BattG) und nach dem Stand der Technik zu behandeln und stofflich zu verwerten (§ 14 BattG). Im Batteriegesetz sind Anzeige- und Rücknahmepflichten sowie Verwertungsanforderungen festgelegt.[140]
Um Lithium-Ionen-Akkumulatoren und primäre Lithium-Ionen-Batterien zu recyclen, werden verschiedene Grundoperationen zu komplexen Prozessketten kombiniert:[141]
- Deaktivieren/Entladen (speziell für Traktionsbatterien)[142]
- Demontage der Batteriesysteme (speziell für Traktionsbatterien)[142]
- mechanische Prozesse (Schreddern, Sortieren, Sieben etc.[141])[142]
- hydrometallurgische Prozesse sowie
- pyrometallurgische Prozesse
Kupfer und Aluminium können häufig vergleichsweise einfach durch mechanische Prozessen getrennt und recycelt werden.[143] Cobalt und Nickel können durch pyrometallurgische Prozesse zurückgewonnen werden. Diese Wertstoffe sind für die Prozessökonomie und Prozessökologie besonders attraktiv. Das Recycling sollte mittelfristig umgesetzt werden, um langfristig Engpässe zu vermeiden.[141] Durch hydrometallurgische Behandlung können Lithiumhydroxid oder Lithiumcarbonat zurückgewonnen werden.[143][144] Bisher (Stand 2019) war das Recycling jedoch nicht rentabel.[145] Das könnte sich ändern, wenn die Anzahl batteriebetriebener Geräte steigt.[138][142]
Das LithoRec Projekt startete im Jahr 2009 die Entwicklung eines neuen Recyclingverfahrens für Lithium-Ionen-Batterien aus Elektro- und Hybridelektrofahrzeugen mit dem Schwerpunkt auf Energieeffizienz und einer hohen stoffliche Verwertungsquote.[143] Die entwickelte Prozessroute kombiniert mechanische, mild-thermische und hydrometallurgische Behandlungen. Ab 2012 wurde die Prozessentwicklung innerhalb einer Testanlage in Braunschweig fortgeführt, in der eine Recyclingrate von 75-80 % erreicht wurde.[144]
Die weltweit erste kommerzielle Recyclinganlage (PosLX) wurde 2017 von POSCO in Gwangyang, Südkorea, in Betrieb genommen. In dieser Anlage wird Lithiumphosphat aus alten Lithium-Ionen-Akkus durch das von POSCO patentierte Verfahren in Lithiumcarbonat, ein Vorprodukt für Lithium, umgewandelt. Die neue Fabrik hat eine Jahresproduktionskapazität von 2.500 Tonnen Lithiumcarbonat.[146][147] Die Anlage der Redux in Bremerhaven kann 10.000 Tonnen sämtlicher Arten von Lithium-Ionen-Batterien pro Jahr bearbeiten.[148][149] Umicore betreibt in Antwerpen eine weitere der größten Recyclinganlagen Europas mit einer Kapazität von 7.000 Tonnen pro Jahr (2018).[145][150] In Deutschland konnten 2020 etwa 20.000 Tonnen recycelt werden, was aber bei steigendem Elektrofahrzeug-Aufkommen nicht hinreichend ist.[134]
In einer Studie aus dem Jahr 2020 wird über den Stand und die Perspektiven des Recyclings von Lithium-Ionen-Batterien aus der Elektromobilität berichtet.[151] Die Rückgewinnung von Lithium ist bislang noch in den wenigsten Verfahren realisiert bzw. befindet sich im Entwicklungsstadium. Darüber hinaus gibt es Aktivitäten zur Rückgewinnung des Graphits. Zu den größten Herausforderungen in den verschiedenen Recyclingprozessen gehört die Beherrschung des Thermischen Durchgehens sowie die hohe Brandlast von Lithium-Ionen-Batterien.
Verfahren zur Lithiumrückgewinnung beim Recycling[Bearbeiten | Quelltext bearbeiten]
Ein Verfahren zur Rückgewinnung von 55 bis 76 Prozent des in den Batterien enthaltenen Lithiums aus alten Lithium-Ionen-Akkus wurde vom Karlsruher Institut für Technologie entwickelt.[152][153] Das mechanochemische Verfahren ermöglicht eine kostengünstige, energieeffiziente und umweltverträgliche Aufbereitung von gebrauchten Akkus. Der Recyclingprozess beginnt mit dem Zermahlen der Akkus in einer Ballmühle ohne vorherige Sortierung oder Zerlegung. Während des Mahlens reagieren die Lithiumverbindungen in den Batterien mit dem in der Kathode enthaltenen Aluminium, das als Reduktionsmittel dient. Das resultierende Gemisch besteht aus metallischen Komponenten, Lithiumoxid und Aluminiumoxid. Magnetische Metalle wie Eisen und Cobalt werden mithilfe eines Magneten entfernt. Im nächsten Schritt wird das Gemisch in Wasser gelöst, gefiltert und durch Verdampfen rekristallisiert. Dabei entstehen Lithiumcarbonat, ein für die Akkuproduktion essentieller Rohstoff, und Lithium-Aluminium-Hydroxyhydrat (LACHH). Das auskristallisierte Pulver wird anschließend auf etwa 350 °C erhitzt, wodurch das LACHH zu Lithiumcarbonat und Aluminiumcarbonat reagiert. In einem weiteren Löse- und Filtrationsschritt wird das Lithiumcarbonat gewonnen, während das Aluminiumcarbonat fest bleibt und abgetrennt werden kann. Im Vergleich zu anderen Methoden werden keine Säuren, korrosiven Chemikalien oder extrem hohen Temperaturen benötigt, was das Verfahren umweltfreundlicher und energiesparender gestaltet. Ein weiterer Vorteil dieses Verfahrens ist seine universelle Einsetzbarkeit: Es funktioniert mit allen derzeit in Kathoden verwendeten Lithiumverbindungen und deren Mischungen. Daher können gebrauchte Batterien unabhängig von ihrer Zusammensetzung ohne Sortierung oder Zerlegung recycelt werden.
Unterschied zu Natrium-Ionen-Akkumulator[Bearbeiten | Quelltext bearbeiten]
Mit den Lithium-Ionen-Akkumulatoren im Aufbau und Verfahren verwandt sind die Natrium-Ionen-Akkumulatoren, welche das Alkalimetall Natrium in Form von Na+-Ionen verwenden und eine ähnliche Typenvariation aufweisen, aber physikalisch bedingt grundsätzlich eine geringere Energiedichte haben.[154] Dank jüngerer Forschungsarbeiten ist der Wandel vom theoretischen Konzept zur praxistauglichen Technologie inzwischen gelungen. Ein koreanischer Prototyp schafft etwa 500 Ladezyklen, bevor die Kapazität auf 80 Prozent fällt. Im Vergleich zur Lithium-Akkutechnik wird die Herstellung von Natrium-Ionen-Akkus nicht durch knappe Ressourcen begrenzt.[155]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren. Mobile Energiequellen für heute und morgen. Springer, Berlin 1998, ISBN 3-540-62997-1.
- Jeff Dahn, Grant M. Ehrlich: Lithium-Ion Batteries. In: Thomas B. Reddy (Hrsg.): Linden's Handbook of Batteries. 4. Auflage. McGraw-Hill, New York 2011, ISBN 978-0-07-162421-3, Kapitel 26.
- Claus Daniel, Jürgen O. Besenhard: Handbook of Battery Materials. Wiley-VCH, Weinheim 2011, ISBN 3-527-32695-2.
- Masaki Yoshio, Ralph J. Brodd, Akiya Kozawa (Hrsg.): Lithium-Ion Batteries. Science and Technologies. Springer, New York 2009, ISBN 978-0-387-34444-7.
- Philipp Adelhelm, Matthias Baumann, Ralf Bindel: Handbuch Lithium-Ionen-Batterien. Hrsg.: Reiner Korthauer. Springer Vieweg, Heidelberg Berlin 2013, ISBN 978-3-642-30653-2.
- Peter Kurzweil, Otto K. Dietlmeier: Elektrochemische Speicher. Springer Vieweg, Wiesbaden 2015, ISBN 978-3-658-10900-4.
- P. Birke, M. Schiemann: Akkumulatoren: Vergangenheit, Gegenwart und Zukunft elektrochemischer Energiespeicher. H. Utz Verlag, München 2013, ISBN 978-3-8316-0958-1, Kapitel 3.1.: Lithium-Ionen-Akkumulatoren. S. 192–235.
- Dell, Rand: Understanding Batteries. Royal Society of Chemistry, 2001, ISBN 0-85404-605-4, S. 147–153, Kapitel 10.4: The Lithium-ion Battery.
- M. Winter, J. O. Besenhard: Wiederaufladbare Batterien. In: Chemie in unserer Zeit, Jg. 1999, Bd. 33, S. 252 und 320.
- Claudia Borchard-Tuch: Lithium-Ionen-Akkus. In: Chemie in unserer Zeit, Jg. 2003, Bd. 37, Heft 6, S. 436–437.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Kompendium: Li‐Ionen‐Batterien (Stand Juli 2015, PDF; 1,2 MB) BMWi Förderprogramm IKT für Elektromobilität II
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Xin Sun, Xiaoli Luo, Zhan Zhang, Fanran Meng, Jianxin Yang: Life cycle assessment of lithium nickel cobalt manganese oxide (NCM) batteries for electric passenger vehicles. In: Journal of Cleaner Production. Band 273. Elsevier, November 2020, ISSN 0959-6526, S. 123006, doi:10.1016/j.jclepro.2020.123006 (elsevier.com).
- ↑ Grant M. Ehrlich: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 35: Lithium-Ion Batteries, S. 35.1–35.94.
- ↑ J. O. Besenhard, H. P. Fritz: Cathodic reduction of graphite in organic solutions of alkali and NR4+ salts. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. Band 53, Nr. 2, 25. Juni 1974, S. 329–333, doi:10.1016/S0022-0728(74)80146-4.
- ↑ J. O. Besenhard: The Electrochemical Preparation and Properties of Ionic Alkali Metal and NR4 Graphite Intercalation Compounds in Organic Electrolytes. In: Carbon. Band 14, Nr. 2, 1976, S. 111–115, doi:10.1016/0008-6223(76)90119-6.
- ↑ R. Schöllhorn, R. Kuhlmann, J. O. Besenhard: Topotactic redox reactions and ion exchange of layered MoO3 bronzes. In: Materials Research Bulletin. Band 11, Nr. 1, Januar 1976, S. 83–90, doi:10.1016/0025-5408(76)90218-X.
- ↑ J. O. Besenhard, R. Schöllhorn: The discharge reaction mechanism of the MoO3 electrode in organic electrolytes. In: Journal of Power Sources. Band 1, Nr. 3, 1976, S. 267–276, doi:10.1016/0378-7753(76)81004-X.
- ↑ J. O. Besenhard, G. Eichinger: High energy density lithium cells: Part I. Electrolytes and anodes. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. Band 68, Nr. 1, 25. Februar 1976, S. 1–18, doi:10.1016/S0022-0728(76)80298-7.
- ↑ G. Eichinger, J. O. Besenhard: High energy density lithium cells: Part II. Cathodes and complete cells. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. Band 72, Nr. 1, 25. August 1976, S. 1–31, doi:10.1016/S0022-0728(76)80072-1.
- ↑ a b c Würdigung für den Nobelpreis für Chemie 2019. nobelprize.org
- ↑ M. Stanley Whittingham: Lithium Batteries and Cathode Materials. In: Chemical Reviews. Band 104, Nr. 10, Oktober 2004, ISSN 0009-2665, S. 4271–4302, doi:10.1021/cr020731c (acs.org).
- ↑ a b c Heng Zhang, Chunmei Li, Gebrekidan Gebresilassie Eshetu, Stéphane Laruelle, Sylvie Grugeon: From Solid‐Solution Electrodes and the Rocking‐Chair Concept to Today's Batteries. In: Angewandte Chemie. Band 132, Nr. 2. Wiley-VCH, 7. Januar 2020, ISSN 0044-8249, S. 542–546, doi:10.1002/ange.201913923 (wiley.com).
- ↑ M. Lazzari, Bruno Scrosati: A Cyclable Lithium Organic Electrolyte Cell Based on Two Intercalation Electrodes. In: Journal of The Electrochemical Society. Band 127, Nr. 3, 1. März 1980, ISSN 0013-4651, S. 773–774, doi:10.1149/1.2129753 (iop.org).
- ↑ K. Mizushima, P. C. Jones, P. J. Wiseman, J. B. Goodenough: LixCoO2 (0 < x < l): A New Cathode Material For Batteries Of High Energy Density. In: Materials Research Bulletin. Band 15, 1980, S. 783–789, doi:10.1016/0025-5408(80)90012-4.
- ↑ Akku für Sony CCD Tr1. In: akku-gebiet.de. Abgerufen am 4. März 2012.
- ↑ Jan Oliver Löfken: Leistungsfähige Anoden aus Silizium. 5. Februar 2021.
- ↑ Stephan Scheuer: Silizium in Batterien: Mercedes und Tesla setzen auf das Supermaterial. Neue Zürcher Zeitung, 8. Juni 2022.
- ↑ Erster Siliziumanoden-Akku ist erhältlich. PEM Motion GmbH, abgerufen am 23. April 2023.
- ↑ Stephan Scheuer: Elektroautos: Tesla und Mercedes setzen auf Batterien mit Silizium. Handelsblatt GmbH, 10. Juni 2022, abgerufen am 23. April 2023.
- ↑ donga.com
- ↑ auto-motor-und-sport.de
- ↑ a b elective.net: „Batterien für die Energiewende: Immer besser, günstiger, globaler“ – Markus Hölzle vom ZSW (Zentrum für Sonnenenergie- und Wasserstoff-Forschung Baden-Württemberg) (ab 0:08:00) auf YouTube, 8. April 2023.
- ↑ Katharina Juschkat: Forscher entwickeln Lithium-Metall-Anoden für Batterie der Zukunft. 24. April 2019.
- ↑ Leveraging Cation Identity to Engineer Solid Electrolyte Interphases for Rechargeable Lithium Metal Anodes. In: Cell Reports Physical Science. 4. November 2020, ISSN 2666-3864, S. 100239, doi:10.1016/j.xcrp.2020.100239 (sciencedirect.com [abgerufen am 6. November 2020]).
- ↑ Akkus: Forscher verbessern Lithium-Batterien. In: DER SPIEGEL. Abgerufen am 6. November 2020.
- ↑ Nadja Podbregar: „Rekordverdächtige“ Lithium-Metall-Batterie entwickelt. scinexx, 16. August 2021.
- ↑ Ralph Diermann: Das Rennen um die Batterie der Zukunft. In: Der Spiegel. 9. Februar 2020, ISSN 2195-1349 (spiegel.de [abgerufen am 3. November 2021]).
- ↑ Memory-Effekt bei Lithium-Ionen-Akkus. heise online, 15. April 2013, abgerufen am 17. Januar 2017.
- ↑ a b c d e Heiner Hans Heimes, Achim Kampker, Christoph Lienemann, Marc Locke, Christian Offermanns, Sarah Michaelis, Ehsan Rhimzei: Produktionsprozess einer Lithium-Ionen-Batteriezelle. RWTH Aachen und VDMA (Verband Deutscher Maschinen- und Anlagenbau), Oktober 2018.
- ↑ Kai Lichte: Expansion of E-component production in Leipzig: First cell coating line for battery modules goes on stream. In: press release. BMW, 1. Februar 2023 (englisch).
- ↑ a b c d moove: VW mit der Einheitszelle gegen Chinas Übermacht, Sebastian Wolf COO bei @volkswagens PowerCo (ab 0:07:40) auf YouTube, 26. April 2024.
- ↑ Christiane Köllner: Batterieelektroden schneller und kostengünstiger herstellen. Springer Professional, 5. August 2019.
- ↑ Thomas B. Reddy, Sohrab Hossain: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 34: Rechargeable Lithium Batteries (Ambient Temperature), S. 34.1–34.4.
- ↑ Naoki Nitta, Feixiang Wu, Jung Tae Lee, Gleb Yushin: Li-ion battery materials: present and future. In: Materials Today. Band 18, Nr. 5, 1. Juni 2015, S. 252–264, doi:10.1016/j.mattod.2014.10.040 (sciencedirect.com [abgerufen am 25. März 2017]).
- ↑ Sébastien Patoux, Lucas Sannier, Hélène Lignier, Yvan Reynier, Carole Bourbon, Séverine Jouanneau, Frédéric Le Cras, Sébastien Martinet,: High voltage nickel manganese spinel oxides for Li-ion batteries. In: Electrochimica Acta. Band 53, Nr. 12, Mai 2008, S. 4137–4145, doi:10.1016/j.electacta.2007.12.054.
- ↑ Flyer: Produktübersicht, aufgerufen am 10. Mai 2012.
- ↑ Flyer (NL): Abschnitt: Actieradius (Hinweis auf Verwendung der Lithium-Mangan-Technologie), aufgerufen am 10. Mai 2012.
- ↑ Kompetenznetzwerk Lithium-Ionen-Batterien e. V.: Lithium-Ionen-Batterien Batterieforum Deutschland
- ↑ a b Lithium Manganese Iron Phosphate (LMFP). NEI Corporation, abgerufen am 8. April 2024.
- ↑ Patentanmeldung WO2015175509A1: structurally controlled deposition of silicon onto nanowires. Angemeldet am 12. Mai 2015, veröffentlicht am 19. November 2015, Anmelder: Amprius Inc, Erfinder: Weijie Wang et al.
- ↑ Ein Elementarer Ansatz für bessere Batteriematerialien. Group14, abgerufen am 23. April 2023: „hartes Gerüst auf Kohlenstoffbasis hält das Silizium in der idealsten Form – amorph, in Nanogröße und mit Kohlenstoff ummantelt [..] siliziumdominierter Verbundstoff, der aus amorphem Silizium in Nanogröße besteht“
- ↑ Patent EP3103149B1: Si/G/C-Komposite für Lithium-Ionen-Batterien. Angemeldet am 23. Januar 2015, veröffentlicht am 18. April 2018, Anmelder: Wacker Chemie AG, Erfinder: Dennis Troegel et al (Silicium/Graphit/Kohlenstoff-Komposite (Si/G/C-Komposite), dadurch gekennzeichnet, dass Graphit (G) und nicht-aggregierte, nanoskalige Silicium-Partikel (Si) enthalten sind, wobei die Silicium-Partikel in eine amorphe Kohlenstoffmatrix (C) eingebettet sind.).
- ↑ iopscience.iop.org
- ↑ Stefan Leichsenring: Porsche beteiligt sich an Spezialist für Silicium-Anodenmaterial. InsideEV, 2. Mai 2022: „Energiedichte von 330 Wh/kg [..] laut Farasis“
- ↑ Sebastian Schaal: Amprius liefert erste Zellen mit 450 Wh/kg aus. Elective.net, 17. Februar 2023, abgerufen am 23. April 2023.
- ↑ https://www.sciencedirect.com/science/article/abs/pii/S2352152X19315373
- ↑ SciB High-power type cells. Toshiba, 2022: „The 2.9Ah SCiB™ cell maintains over 80% of its initial capacity after 40,000 charge/discharge cycles at a tough charge/discharge rate (10C) and high temperature (35°C) conditions.“
- ↑ M. Wohlfahrt-Mehrens, C. Vogler, J. Garche: Aging mechanisms of lithium cathode materials. In: Journal of Power Sources. 127, Nr. 1–2, 2004, S. 58–64, doi:10.1016/j.jpowsour.2003.09.034.
- ↑ Gaurav Sharma, Yi Jin, Y. S. Lin: Lithium Ion Batteries with Alumina Separator for Improved Safety. In: Journal of The Electrochemical Society. Band 164, Nr. 6, 1. Januar 2017, ISSN 0013-4651, S. A1184–A1191, doi:10.1149/2.1091706jes (ecsdl.org [abgerufen am 18. Juni 2018]).
- ↑ Mehr Reichweite für Elektroautos. Schott AG
- ↑ tietEK: technology concept for inspectation and exploration of the deep sea, Fraunhofer IOSB
- ↑ Altana und CCI kooperieren bei der Entwicklung von Energiespeichersystemen. In: chemanager-online.com, 23. Januar 2014.
- ↑ INTERNATIONAL STANDARD – IEC 60086-1. (PDF; 529 kB) In: cnlumos.com. International Electrotechnical Commission, Dezember 2006, archiviert vom (nicht mehr online verfügbar) am 25. November 2011; abgerufen am 15. März 2012 (englisch).
- ↑ Li-ion 21700: LG M50 5000mAh vs Samsung 48G 4800mAh discharge capacity test in thunderheartreviews.com, abgerufen am 2. Januar 2020.
- ↑ Thomas Kuther: 21700er-Akku-Rundzellen: oft die bessere Alternative. In: Elektronik Praxis. 5. Februar 2020, abgerufen am 27. Juni 2021.
- ↑ Manne Schmitt: Leistungsfähigere und zugleich günstigere Batterien – Nicht nur für Tesla, sondern auch für E-Bikes? In: E-Mountainbike. 1. Oktober 2020, abgerufen am 27. Juni 2021.
- ↑ electrive.net vom 2. Januar 2021, Panasonic: Bau der 4680-Batteriezelle für Tesla soll 2021 starten, abgerufen am 24. Juni 2021.
- ↑ a b Stefan Leichsenring: BMWs Neue Klasse erhält 4695- und 46120-Zellen (Update). In: insideevs.de. 10. September 2022, abgerufen am 5. Januar 2023.
- ↑ Isidor Buchmann: Ist Lithium-Ion die ideale Batterie? In: Plattform für die Förderung und Verbreitung von Elektrofahrzeugen. Archiviert vom (nicht mehr online verfügbar) am 22. November 2015; abgerufen am 17. Dezember 2011.
- ↑ Grant M. Ehrlich: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 35: Lithium-Ion Batteries, S. 35.2.
- ↑ a b Life-Cycle Testing of Mars Surveyor Program Lander Lithium Ion Battery Achieved Over 10,000 Low-Earth-Orbit Cycles. ( vom 9. September 2013 im Internet Archive) In: NASA.gov, 16. Oktober 2006.
- ↑ PDF bei www.et-inf.fho-emden.de ( vom 12. April 2013 im Internet Archive)
- ↑ Wirkungsgrade verschiedener Stromspeicher. In: statista. Abgerufen am 31. Januar 2024.
- ↑ Kurzweil, Dietlmeier: Elektrochemische Speicher S. 223 Tab. 318.
- ↑ a b c d Charging lithium-ion batteries. In: BORDER RADIO CLUB Newsletter. März 2006.
- ↑ Grant M. Ehrlich: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 35: Lithium-Ion Batteries, S. 35.3.
- ↑ Isidor Buchmann: Wann wurde die Batterie erfunden? ( vom 22. Januar 2012 im Internet Archive) In: Batterien-Montage-Zentrum GmbH.
- ↑ Battery Management Systems (BMS). In: Electropaedia.
- ↑ Multi-Cell Li-ion Battery Pack OCP/Analog Front End bei intersil ( vom 1. April 2010 im Internet Archive)
- ↑ Philipp Adelhelm, Matthias Baumann, Ralf Bindel: Handbuch Lithium-Ionen-Batterien. Hrsg.: Reiner Korthauer. Springer Vieweg, Heidelberg Berlin 2013, ISBN 978-3-642-30653-2, S. 15.
- ↑ Produktbeschreibung SCiB von Toshiba ( vom 27. August 2010 im Internet Archive)
- ↑ Lance Ulanoff: Why your iPhone battery meter sometimes goes haywire – Your iPhone battery meter is (probably) lying to you. Abschnitt Fuzzy Science, 5. Februar 2017. In: Mashable.com
- ↑ Lithium-Ionen-Akku. In: qsl.net.
- ↑ a b Winston Battery: WB-LYP100AHA. ( des vom 7. Juni 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Datenblatt LiFePO4-Zelle 3,2 V 100 Ah, eingefügt am 11. Februar 2012.
- ↑ Bernhard Haluschak: Akkus: Kurzlebig ab Werk. ( vom 24. Juni 2008 im Internet Archive) In: Tecchannel. 23. September 2005.
- ↑ M. Frehner, 2007: Alles über Akkus Abschnitt: Selbstentladung. In: funkcom.ch, abgerufen am 15. Februar 2012.
- ↑ Sebastian Buechele, Anu Adamson, Ahmed Eldesoky, Tom Boetticher, Louis Hartmann, Thomas Boulanger, Saad Azam, Michel B. Johnson, Tina Taskovic, Eric Logan, Michael Metzger: Identification of Redox Shuttle Generated in LFP/Graphite and NMC811/Graphite Cells. In: Journal of The Electrochemical Society. Band 170, Nr. 1, 1. Januar 2023, ISSN 0013-4651, S. 010511, doi:10.1149/1945-7111/acaf44.
- ↑ Dal researchers' chance discovery could help extend battery life by replacing tape that causes self‑discharge. Abgerufen am 22. Februar 2023 (englisch).
- ↑ Erhöhte Brandgefahr in Krankenhäusern: Lagerungsproblematik Lithium-Ionen-Batterien. Abgerufen am 27. Juni 2019 (deutsch).
- ↑ a b Jürgen Kunkelmann: Studie zur Brandbekämpfung von Lithium-Ionen-Batterien (Akkus) und Lithium-Metall-Batterien. Karlsruher Institut für Technologie (KIT), Forschungsstelle für Brandschutztechnik, Oktober 2017, abgerufen am 28. August 2023.
- ↑ a b Kai-Philipp Kairies, Dirk Uwe Sauer: Alterungsmechanismen von Lithium-Ionen Batterien. Lehrstuhl für Elektrochemische Energiewandlung und Speichersystemtechnik RWTH Aachen, 2. April 2019, abgerufen am 6. Januar 2024.
- ↑ a b Michael Sterner, Ingo Stadler: Energiespeicher - Bedarf, Technologien, Integration. Springer, Berlin Heidelberg.
- ↑ Georg Angenendt: Operation, Optimization and Additional Market Participation of Households with PV Battery Storage System and Power-to-Heat Application. Fakultät für Elektrotechnik und Informationstechnik RWTH Aachen, 2019, abgerufen am 23. Februar 2024.
- ↑ Isidor Buchmann: Will Lithium-Ion batteries power the new millennium? ( vom 17. Oktober 2015 im Internet Archive) September 2008.
- ↑ Richard L. Hartmann II, An aging model for lithium-ion cells. S. 75–79, Dissertation an der University of Akron (PDF; 3,4 MB), abrufbar am 15. Oktober 2021.
- ↑ PRESSEMELDUNG: Apple aktualisiert die MacBook Pro Familie mit neuen Modellen und einer innovativen, eingebauten Batterie mit bis zu 40 Prozent längerer Laufzeit. Apple Inc, 8. Juni 2009, abgerufen am 31. Juli 2017.
- ↑ macbookbatterydatabase.com abgerufen am 1. August 2017.
- ↑ Teure Pedelec-Batterien und ihre Haltbarkeit 10/2015. In: adac.de. Oktober 2015, archiviert vom (nicht mehr online verfügbar) am 18. Oktober 2021; abgerufen am 24. April 2023.
- ↑ B. Ketterer, U. Karl, D. Möst, S. Ulrich (Forschungszentrum Karlsruhe): Lithium-Ionen Batterien: Stand der Technik und Anwendungspotenzial in Hybrid-, Plug-In Hybrid- und Elektrofahrzeugen, Seite 47 mit Anhang 10. In: publikationen.bibliothek.kit.edu. Oktober 2009, abgerufen am 15. Oktober 2021.
- ↑ Steffen Wienands, Berner Fachhochschule: Die Lithium-Ionen-Batterie – Grundlagen, Anwendungen und Zukunftsperspektiven, Seite 12 (PDF). (PDF) 6. Dezember 2020, abgerufen am 15. Oktober 2021.
- ↑ Jens Tartler: Wenn elf Avocados umweltschädlicher als eine E-Auto-Batterie sind. In: tagesspiegel.de. 4. Dezember 2019, abgerufen am 15. Oktober 2021.
- ↑ a b Valentin Crastan: Elektrische Energieversorgung 2. Springer Berlin Heidelberg, 2011, ISBN 978-3-642-19856-4, S. 483 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Thomas Waldmann, Marcel Wilka, Michael Kasper, Meike Fleischhammer, Margret Wohlfahrt-Mehrens: Temperature dependent ageing mechanisms in Lithium-ion batteries – A Post-Mortem study. In: Journal of Power Sources. Band 262, 2014, S. 129–135, doi:10.1016/j.jpowsour.2014.03.112.
- ↑ Thomas Waldmann, Margret Wohlfahrt-Mehrens: In-Operando Measurement of Temperature Gradients in Cylindrical Lithium-Ion Cells during High-Current Discharge. In: ECS Electrochemistry Letters. Band 4, 2015, S. A1–A3, doi:10.1149/2.0031501eel.
- ↑ Thomas Waldmann, Gunther Bisle, Björn-Ingo Hogg, Stefan Stumpp, Michael A. Danzer, Michael Kasper, Peter Axmann, and Margret Wohlfahrt-Mehrens: Influence of Cell Design on Temperatures and Temperature Gradients in Lithium-Ion Cells: An In Operando Study. In: Journal of The Electrochemical Society. Band 162, 2015, S. A921–A927, doi:10.1149/2.0561506jes.
- ↑ Micah S. Ziegler, Jessika E. Trancik: Re-examining rates of lithium-ion battery technology improvement and cost decline. In: Energy & Environmental Science. Band 14, Nr. 4, 2021, ISSN 1754-5692, S. 1635–1651, doi:10.1039/D0EE02681F (rsc.org [abgerufen am 26. April 2022]).
- ↑ The price of batteries has declined by 97 % in the last three decades. Abgerufen am 26. April 2022.
- ↑ Nancy Haegel et al: Terawatt-scale photovoltaics: Transform global energy. In: Science. Band 364, Nr. 6443, 2019, S. 836–838, doi:10.1126/science.aaw1845.
- ↑ Micah S. Ziegler, Jessika E. Trancik: Re-examining rates of lithium-ion battery technology improvement and cost decline. In: Energy and Environmental Science. 2021, doi:10.1039/d0ee02681f.
- ↑ Battery Pack Prices Cited Below $100/kWh for the First Time in 2020, While Market Average Sits at $137/kWh. In: Bloomberg, 16. Dezember 2020. Abgerufen am 12. Februar 2021.
- ↑ Cost and Price Metrics for Automotive Lithium-Ion Batteries. (PDF) In: energy.gov. Februar 2017, abgerufen am 1. August 2017.
- ↑ UN-Transportverordnung für Lithiumbatterien. Abgerufen am 8. März 2017.
- ↑ Lithium Battery Testing Under UN/DOT 38.3. (PDF) TÜV Süd America, abgerufen am 11. März 2017 (englisch).
- ↑ Regelung für die Beförderung von gefährlichen Stoffen und Gegenständen. ( vom 9. Mai 2012 im Internet Archive) DHL Vertriebs GmbH & Co OHG Marktkommunikation (PDF; 132 kB)
- ↑ SV 188. Abgerufen am 10. Februar 2019.
- ↑ Versandklassen von Lithium-Ionen-Akkus / Lithium-Batterien. Abgerufen am 21. März 2022.
- ↑ ADR 2019 – Unterabschnitt 5.2.1.9
- ↑ Luftfahrt Bundesamt – Passagiergepäck. Abgerufen am 10. Februar 2019.
- ↑ Kai Dürfeld: Lithium-Dendriten auf der Spur: Wie zerstörerische Strukturen in Batterien wachsen. Helmholtz-Zentrum Berlin, 1. September 2021, abgerufen am 24. April 2023.
- ↑ Gerd Kucera: Dendriten: Gefahrenquelle für den Akku-Kurzschluss. Vogel Communications Group GmbH & Co. KG, 19. Oktober 2021, abgerufen am 24. April 2023.
- ↑ Grant M. Ehrlich: Handbook Of Batteries. Hrsg.: David Linden, Thomas B. Reddy. 3. Auflage. McGraw-Hill, 2002, ISBN 0-07-135978-8, Kapitel 35: Lithium-Ion Batteries, S. 35.8–35.9.
- ↑ Peter J. Bugryniec, Jonathan N. Davidson, Solomon F. Brown: Assessment of thermal runaway in commercial lithium iron phosphate cells due to overheating in an oven test. In: Energy Procedia. Band 151, Oktober 2018, ISSN 1876-6102, S. 74–78, doi:10.1016/j.egypro.2018.09.030.
- ↑ DGUV: FAQ-Liste der AG „Handlungsrahmen Elektromobilität“. (PDF) 1. August 2016, abgerufen am 14. März 2019.
- ↑ Gigaset ruft Telefon-Akkus wegen Überhitzung zurück. In: heise online. 15. Dezember 2011, abgerufen am 17. Januar 2017.
- ↑ Elektromobilität – Abschätzung arbeitswissenschaftlich relevanter Veränderungen In: baua.de, Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, 2012, abgerufen am 28. März 2012.
- ↑ ssu: Opel verkauft vorerst keinen Ampera. In: heise.de. 14. Dezember 2011, abgerufen am 11. Mai 2022.
- ↑ Opel-Mutterkonzern kriegt Flammengefahr in den Griff. In: Spiegel Online. 6. Januar 2012, abgerufen am 13. Februar 2012.
- ↑ Elektroauto an Tankstelle in Ratingen brennt vollkommen aus. In: nrz.de. 19. September 2019, abgerufen am 21. Oktober 2019.
- ↑ Jörn Kerckhoff: Mobilitätswende: Wenn Elektroautos brennen. In: moz.de. 25. September 2019, abgerufen am 21. Oktober 2019.
- ↑ Pannendienste müssen aufrüsten wegen E-Autos. In: 20min.ch. 18. Oktober 2019, abgerufen am 19. Oktober 2019.
- ↑ Elektroauto auf der A4 in Brand geraten – Strecke zwischen Goldau und Küssnacht war gesperrt. In: luzernerzeitung.ch. 21. Oktober 2019, abgerufen am 21. Oktober 2019.
- ↑ Akku-Brand bei Lastenrad: Feuerwehr muss Elektro-Bike in Container tauchen. In: Focus Online. 17. September 2021, abgerufen am 11. Mai 2022.
- ↑ M. Armand, J.-M. Tarascon: Building better batteries. In: Nature. Band 451, 2008, S. 652–657, doi:10.1038/451652a.
- ↑ Boucar Diouf, Ramchandra Pode: Potential of lithium-ion batteries in renewable energy. In: Renewable Energy. Band 76, 2015, S. 375–380, doi:10.1016/j.renene.2014.11.058.
- ↑ D. Larcher, J-M. Tarascon: Towards greener and more sustainable batteries for electrical energy storage. In: Nature Chemistry. Band 7, 2015, S. 19–29, doi:10.1038/NCHEM.2085.
- ↑ Jens F. Peters et al.: The environmental impact of Li-Ion batteries and the role of key parameters – A review. In: Renewable and Sustainable Energy Reviews. Band 67, S. 491–506, doi:10.1016/j.rser.2016.08.039.
- ↑ Erik Emilsson, Lisbeth Dahllöf: Lithium-Ion Vehicle Battery Production. IVL. Abgerufen am 2. Dezember 2019.
- ↑ Linda Ager-Wick Ellingsen: Identifying key assumptions and differences in life cycle assessment studies of lithium-ion traction batteries with focus on greenhouse gas emissions. In: Transportation Research Part D: Transport and Environment. Band 55, 2017, S. 82–90, doi:10.1016/j.trd.2017.06.028.
- ↑ Nikolas Hill, Sofia Amaral, Samantha Morgan-Price, Tom Nokes, Judith Bates, Hinrich Helms, Horst Fehrenbach, Kirsten Biemann, Nabil Abdalla, Julius Jöhrens, Eloise Cotton, Lizzie German, Anisha Harris, Sebastien Haye, Chris Sim, Ausilio Bauen: Determining the environmental impacts of conventional and alternatively fuelled vehicles through LCA. Final Report for the European Commission, DG Climate Action, Contract Ref. 34027703/2018/782375/ETU/CLIMA.C.4. Hrsg.: European Commission. Brüssel 2020, ISBN 978-92-76-20301-8, doi:10.2834/91418.
- ↑ Volkswagen startet Batterie-Recycling in Salzgitter. handelsblatt.com, 29. Januar 2021, abgerufen am 28. Februar 2021.
- ↑ Recycling und Entsorgung von E-Auto-Batterien. REMONDIS Industrie Service, 1. Juni 2020, abgerufen am 27. Mai 2021.
- ↑ motorradonline.de von 22. Dezember 2020, Zero im Netzwerk für Altbatterien, abgerufen am 27. Mai 2021.
- ↑ auto-motor-und-sport.de
- ↑ golem.de vom 28. Mai 2019, Viel zu wertvoll zum Wegwerfen, abgerufen am Mai 2021.
- ↑ a b Christopher Schrader: Die Altlast der Elektromobilität. In: spektrum.de. Spektrum der Wissenschaft Verlagsgesellschaft, 9. Juli 2020, abgerufen am 19. November 2023.
- ↑ Peter Dolega, Matthias Buchert, Johannes Betz: Ökologische und sozio-ökonomische Herausforderungen in Batterie-Lieferketten: Graphit und Lithium. (PDF) Kurzstudie erstellt im Rahmen des BMBF Verbundprojektes Fab4Lib – Forschung zu Maßnahmen zur Steigerung der Material- und Prozesseffizienz bei der Herstellung von Lithium-Ionen-Batteriezellen entlang der gesamten Wertschöpfungskette (FKZ 03XP0142E). Oeko-Institut e. V., 29. Juli 2020, abgerufen am 18. Oktober 2020.
- ↑ Susanne Götze, Kehrseite der Energiewende, im Deutschlandfunk am 30. April 2019, abgerufen am 9. März 2021.
- ↑ Sascha Zoske: Forschungsprojekt: Was Handy-Akkus mit Wasserknappheit zu tun haben. In: FAZ.NET. ISSN 0174-4909 (faz.net [abgerufen am 23. März 2021]).
- ↑ a b SZ vom 13. März 2019: Warum Lithium aus Akkus immer noch im Müll landet
- ↑ Erhöhte Brandgefahr in Krankenhäusern: Lagerungsproblematik Lithium-Ionen-Batterien. Abgerufen am 27. Juni 2019 (deutsch).
- ↑ BattG – Gesetz über das Inverkehrbringen, die Rücknahme und die umweltverträgliche Entsorgung von Batterien und Akkumulatoren. Abgerufen am 27. Juni 2019.
- ↑ a b c Christian Hanisch, Jan Diekmann, Alexander Stieger, Wolfgang Haselrieder & Arno Kwade: Handbook of Clean Energy Systems – Recycling of Lithium-Ion Batteries. Hrsg.: Jinyue Yan, Luisa F. Cabeza, Ramteen Sioshansi. 5 Energy Storage Auflage. John Wiley & Sons, Ltd, 2015, ISBN 978-1-118-99197-8, Kap. 27, S. 2865–2888, doi:10.1002/9781118991978.hces221.
- ↑ a b c d recyclingnews.de vom 31. Juli 2018, Energie für die Zukunft: Recycling von Lithium-Ionen-Akkus, abgerufen am 10. März 2021.
- ↑ a b c Christian Hanisch, Wolfgang Haselrieder und Arno Kwade: Recycling von Lithium-Ionen-Batterien. (PDF) 2012, abgerufen am 27. März 2022.
- ↑ a b Recycling of Lithium-Ion Batteries. In: Sustainable Production, Life Cycle Engineering and Management. 2018, ISSN 2194-0541, S. 33, doi:10.1007/978-3-319-70572-9.
- ↑ a b Hellmuth Nordwig: Das mühsame Recycling von Lithium-Ionen-Akkus. In: Forschung aktuell (Rundfunksendung auf DLF). 23. Januar 2019, abgerufen am 10. Oktober 2019.
- ↑ Jung Min-hee: Urban Lithium Mine POSCO Starts Commercial Lithium Production for First Time in the World. Business Korea, 8. Februar 2017, abgerufen am 10. Februar 2017 (englisch).
- ↑ Moon Ji-woong: Posco begins commercial lithium carbonate production in Korea. Pulse News, 7. Februar 2017, abgerufen am 10. Februar 2017 (englisch).
- ↑ Janet Binder: Batterien: Kleine Recycling-Quote. welt.de, 26. Juni 2018, abgerufen am 8. März 2021.
- ↑ Redux: Innovatives Recycling von Lithium-Ionen-Batterien in Bremerhaven geht an den Start. elektroauto-news.net, 10. Juni 2018, abgerufen am 13. März 2021.
- ↑ Wohin mit den alten Akkus der E-Autos? elektroauto-news.net, 10. Januar 2018, abgerufen am 8. März 2021.
- ↑ Matthias Buchert, Jürgen Sutter: Stand und Perspektiven des Recyclings von Lithium-Ionen-Batterien aus der Elektromobilität. Synthesepapier erstellt im Rahmen des vom Bundesministerium für Umwelt, Naturschutz und nukleare Sicherheit geförderten Verbundvorhabens MERCATOR „Material Effizientes Recycling für die Circular Economy von Automobilspeichern durch Technologie ohne Reststoffe“. Hrsg.: Öko-Institut. Darmstadt 24. August 2020 (oeko.de [PDF; 321 kB]).
- ↑ Oleksandr Dolotko, Niclas Gehrke, Triantafillia Malliaridou, Raphael Sieweck, Laura Herrmann, Bettina Hunzinger, Michael Knapp, Helmut Ehrenberg: Universal and efficient extraction of lithium for lithium-ion battery recycling using mechanochemistry. In: Communications Chemistry. Band 6, Nr. 1, 28. März 2023, ISSN 2399-3669, S. 1–8, doi:10.1038/s42004-023-00844-2 (nature.com [abgerufen am 21. April 2023]).
- ↑ Nadja Podbregar: Lithium aus alten Akkus. 20. April 2023, abgerufen am 21. April 2023 (deutsch).
- ↑ Jang-Yeon Hwang, Seung-Taek Myung, Yang-Kook Sun: Sodium-ion batteries: present and future. In: Chemical Society Reviews. Band 46, Nr. 12, Juni 2017, S. 3529 – 3614, doi:10.1039/C6CS00776G.
- ↑ Frank Wunderlich-Pfeiffer: Ausnahmsweise ein echter Durchbruch in der Akkutechnik. In: Golem.de. 17. Juni 2020, abgerufen am 25. November 2020.