Kupfer
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Kupfer, Cu, 29 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 11, 4, d | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | lachsrosa, metallisch | |||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer |
7440-50-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,01 %[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[A 1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 63,546(3)[2] u | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 135 (145) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 132 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d10 4s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 745,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1957,9 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[A 1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 8,92 g/cm³ (20 °C)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 3,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (Χm = −9,6 · 10−6)[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1357,77 K (1084,62 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 2868 K[5] (2595 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 7,11 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 305 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 13,3[6] kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 3570 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 385[1] J·kg−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 4,65 eV[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 58,1 · 106 S·m−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 400 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanisch[A 1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| E-Modul | 100…130 GPa[8][9] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Poissonzahl | 0,34…0,35[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[A 1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 1, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,340 V (Cu2+ + 2 e− → Cu) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,9 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,1 mg·m−3 (gemessen als einatembarer Staub)[12] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||
Kupfer (lat. Cuprum) ist ein chemisches Element mit dem Elementsymbol Cu und der Ordnungszahl 29. Es ist ein Übergangsmetall, im Periodensystem steht es in der 4. Periode und der 1. Nebengruppe (nach neuer Zählung Gruppe 11) oder Kupfergruppe. Der lateinische Name cuprum ist abgeleitet von (aes) cyprium „Erz von der griechischen Insel Zypern“, auf der im Altertum Kupfer gewonnen wurde.
Kupfer ist als relativ weiches Metall gut formbar und zäh. Als hervorragender Wärme- und Stromleiter findet es vielseitige Verwendung. Darüber hinaus zählt es auch zur Gruppe der Münzmetalle.
Als schwach reaktives Schwermetall gehört Kupfer zu den Halbedelmetallen.
Geschichte


Kupfer, Gold, Silber und Zinn waren die ersten Metalle, welche die Menschheit in ihrer Entwicklung kennenlernte. Da Kupfer leicht zu verarbeiten ist, wurde es bereits von den ältesten bekannten Kulturen vor etwa 10.000 Jahren verwendet. Die Zeit seines weiträumigen Gebrauchs vom 5. Jahrtausend v. Chr. bis zum 3. Jahrtausend v. Chr. wird je nach Region auch Kupferzeit genannt. In Hujayrat al-Ghuzlan in Jordanien bestand schon um 4.000 v. Chr. eine Massenproduktionsstätte von Kupfer. In der Alchemie wurde Kupfer mit Venus/Weiblichkeit ♀ (Planetenmetalle) assoziiert und als Verbindung von Schwefel und Quecksilber[13] angesehen. Die ersten Spiegel wurden aus diesem Metall hergestellt. Während der späten ostmediterranen Bronzezeit wurde Kupfer vor allem auf Zypern gefördert und von dort in zumeist ca. 30 kg schweren Kupferbarren in Form von Rinderhäuten (sogenannte Ochsenhautbarren) exportiert. Fragmente zyprischer Ochsenhautbarren aus der Zeit zwischen dem 16. und dem 11. Jahrhundert v. Chr. finden sich in weiten Teilen des Mittelmeerraums, bis nach Sardinien, auf dem Balkan und sogar nördlich der Alpen (Depotfund von Oberwilflingen).[14] Größter vorindustrieller Kupferhersteller war das Römische Reich mit einer geschätzten Jahresproduktion von 15.000 t.[15]
Später wurde Kupfer mit Zinn und Bleianteilen zu Bronze legiert. Diese härtere und technisch widerstandsfähigere Legierung wurde zum Namensgeber der Bronzezeit. Die Unterscheidung von Blei und Zinn wurde erst mit wachsenden Metallkenntnissen eingeführt, sodass der Begriff Bronze aus heutiger Sicht nur auf die hochkupferhaltigen Zinn-Kupferlegierungen richtig angewendet ist.
Die goldgelbe Kupfer-Zink-Legierung „Messing“ war bereits im antiken Griechenland bekannt. Es wurde durch gemeinsames Verarbeiten der jeweiligen Erze erschmolzen, aber erst die Römer haben dieses Verfahren verstärkt verwendet. In Altkolumbien wurde die Gold-Kupfer-Legierung Tumbaga häufig verwendet.
Vorkommen
Kupfer kommt in der Erdkruste mit einem Gehalt von etwa 0,006 % vor und steht damit in Bezug auf die Häufigkeit der Elemente in der Erdkruste an der 23. Stelle.[16] Häufig tritt Kupfer gediegen, das heißt in elementarer Form auf. Weltweit sind aktuell (Stand 2017) über 3000 Fundorte für gediegen Kupfer bekannt, so unter anderem in Afghanistan, Argentinien, Australien, Belgien, Bolivien, Brasilien, Bulgarien, Chile, China, der Demokratischen Republik Kongo, Deutschland, Finnland, Frankreich, Griechenland, Indien, im Iran, in Irland, Italien, Japan, Kanada, Kasachstan, Marokko, Mexiko, der Mongolei, Namibia, Neuseeland, Norwegen, Österreich, Peru, den Philippinen, Polen, Portugal, Rumänien, Russland, Sambia, Schweden, der Schweiz, Simbabwe, der Slowakei, Spanien, Südafrika, Tschechien, der Türkei, der Ukraine, Ungarn, den Vereinigten Staaten von Amerika (USA) und dem Vereinigten Königreich (UK).[17]
Auch in mehreren Gesteinsproben vom Mittelatlantischen Rücken sowie vom Mond, das die Sonde der Luna 24-Mission vom Mare Crisium mitbrachte, konnte gediegen Kupfer nachgewiesen werden.[17]
Kupfer als Mineral
Natürliche Vorkommen an gediegen Kupfer, das heißt in seiner elementaren Form, waren bereits lange vor der Gründung der International Mineralogical Association (IMA) bekannt. Kupfer ist daher als sogenanntes grandfathered Mineral als eigenständige Mineralart anerkannt.[18]
Gemäß der Systematik der Minerale nach Strunz (9. Auflage) wird Kupfer unter der System-Nr. „1.AA.05“ (Elemente – Metalle und intermetallische Verbindungen – Kupfer-Cupalit-Familie – Kupfergruppe)[19] beziehungsweise in der veralteten 8. Auflage unter I/A.01 (Kupfer-Reihe) eingeordnet. Die vorwiegend im englischsprachigen Raum verwendete Systematik der Minerale nach Dana führt das Element-Mineral unter der System-Nr. 01.01.01.03 (Goldgruppe).[20]
In der Natur bildet sich Kupfer meist in basaltischen Laven entweder in Form von „kupferroten“, metallisch glänzenden Nuggets (aus der Schmelze erstarrt) oder in verzweigten Strukturen, so genannten Dendriten. Gelegentlich sind auch kristalline Ausbildung anzutreffen. Kupfer tritt in Paragenese mit verschiedenen, meist sekundären Kupfermineralen wie Bornit, Chalkosin, Cornwallit, Cuprit, Azurit und Malachit sowie Tenorit auf, kann aber auch mit vielen anderen Mineralen wie Calcit, Klinoklas, Prehnit, Pumpellyit, Quarz und Silber vergesellschaftet sein.[21][22]
-
Kupfer-Nugget
-
Kupfer-Dendriten
-
Würfelige Kupfer-Kristalle
-
Pseudomorphose von Kupfer nach Aragonit
Kupfererze kommen häufig vor. So wird Kupfer aus Chalkopyrit (Kupferkies, CuFeS2), Chalkosin (Kupferglanz, Cu2S), seltener auch aus Bornit (Buntkupferkies, Cu5FeS4), Atacamit (CuCl2·Cu(OH)2), Malachit (Cu2[(OH)2|CO3]) und anderen Erzen gewonnen. Im Jahre 2019 waren 636 Kupferminerale bekannt. Die Minerale mit der höchsten Kupferkonzentration in der Verbindung sind Cuprit (bis 88,8 %) und Algodonit (bis 83,6 %) sowie Paramelaconit, Tenorit und Chalkosin (bis 79,9 %).[23]
Förderung
Produzenten
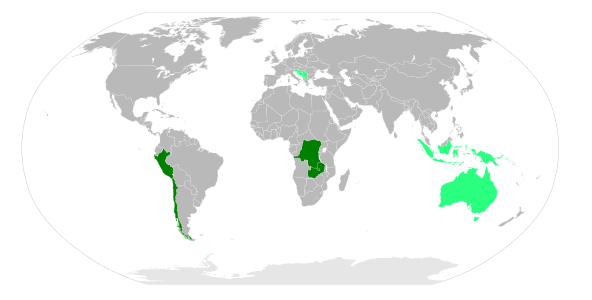
Der bedeutendste Kupferproduzent ist Chile, mit großem Abstand gefolgt von Peru und den USA. In Europa sind Polen, Portugal und Schweden nennenswert. Die wichtigsten Exportländer waren von 1967 bis 1988 in der CIPEC organisiert. Zur CIPEC gehörten unter anderem Chile, Peru und Papua-Neuguinea, auf dessen Insel Bougainville eine der weltgrößten Kupferminen 1988 zu einem Bürgerkrieg führte.
Historisch bedeutsam waren die Kupfergruben auf der Keweenaw-Halbinsel im Oberen See (USA). Dort gab es das weltweit größte Vorkommen von gediegen Kupfer. Abbau fand dort schon in vorkolumbischer Zeit statt. In Deutschland wurde bis 1990 im Mansfelder Land Kupferschiefer abgebaut und in Cornwall hat es vor allem im 18. und 19. Jahrhundert bedeutenden Kupferbergbau gegeben.[24]
-
Mitgliedsstaaten der CIPEC
-
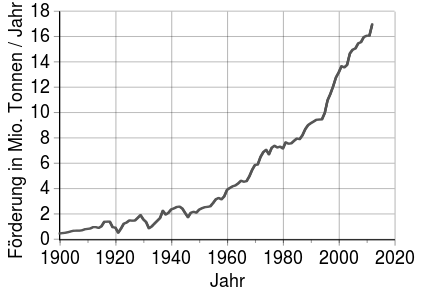
Entwicklung der Kupferförderung (1900–2012)
| Rang | Land | Förderung | Reserven |
|---|---|---|---|
| 1 | Chile | 5800 | 170.000 |
| 2 | Peru | 2400 | 83.000 |
| 3 | Volksrepublik China | 1600 | 26.000 |
| 4 | Vereinigte Staaten | 1200 | 48.000 |
| 5 | Demokratische Republik Kongo | 1200 | 20.000 |
| 6 | Australien | 950 | 88.000 |
| 7 | Sambia | 870 | 19.000 |
| 8 | Indonesien | 780 | 51.000 |
| 9 | Mexiko | 760 | 50.000 |
| 10 | Russland | 710 | 61.000 |
Gewinnung

Verschiedene Verfahren
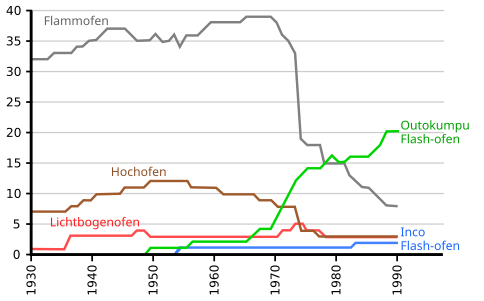
Die wichtigsten Öfen für die Kupfergewinnung sind der Flammofen und seit 1980 der Schwebeschmelzofen.
Prozess der Kupfergewinnung
Zur Herstellung von Kupfer wird aus Kupferkies (CuFeS2) zunächst so genannter Kupferstein (Cu2S mit variierenden Gehalten an FeS, Cu-Gehalt ca. 70 %) gewonnen. Dazu wird das Ausgangsmaterial unter Zusatz von Koks geröstet und die enthaltenen Eisenoxide durch kieselsäurehaltige Zuschlagstoffe verschlackt. Diese Eisensilikat-Schlacke schwimmt auf dem Kupferstein und kann so leicht abgegossen werden.
- Röstarbeit:
- Schmelzarbeit:
Der so erhaltene Kupferstein wird zu Rohkupfer (auch Schwarzkupfer) weiterverarbeitet. Dazu wird er glutflüssig in einen Konverter gegossen und in diese Schmelze Luft eingeblasen. In einer ersten Stufe (Schlackenblasen) wird dabei das darin enthaltene Eisensulfid zu Eisenoxid geröstet und dieses durch zugeschlagenen Quarz zur Schlacke gebunden, die abgegossen werden kann. In einem zweiten Schritt (Garblasen) werden zwei Drittel des verbleibenden Cu2S zu Cu2O oxidiert. Das Oxid setzt sich dann mit dem restlichen Sulfid zum Rohkupfer um.
- Schlackenblasen:
- Garblasen:
Das Rohkupfer hat einen Kupferanteil von 98 %. In den restlichen 2 % sind neben unedlen Metallen wie Eisen und Zink auch Edelmetalle wie Silber und Gold enthalten. Die elektrolytische Raffination von Kupfer wird in einer schwefelsäurehaltigen Kupfer(II)-sulfat-Lösung mit einer Rohkupfer-Anode und einer Reinkupfer-Kathode durchgeführt. Bei der Elektrolyse werden nun alle im Vergleich zu Kupfer unedleren Metalle oxidiert und gehen als Kationen in Lösung, während die edleren Metalle als Anodenschlamm absinken.
Reaktionsgleichung der elektrolytischen Raffination:
- Anode
- Kathode
Während die Anode sich langsam unter Bildung der Kationen auflöst, scheidet sich an der Kathode durch Reduktion von Kupferionen ausschließlich Kupfer, das Elektrolytkupfer, mit einem Massenanteil von w(Cu) = 99,99 % ab.
Der als Nebenprodukt entstehende Anodenschlamm wird später weiter verwertet und dient als Ausgangsmaterial für die Gewinnung der Edelmetalle.
Die Gewinnung von Kupfer erfolgt in Affinerien. In Europa ist dafür die Aurubis AG (früher Norddeutsche Affinerie) mit Hauptsitz in Hamburg bekannt, früher war es auch die Duisburger Kupferhütte (heute DK Recycling).
Kupfer kann auch als so genannter Zementkupfer durch Fällung aus Kupfersulfat-Lösung mit Eisen gewonnen werden. Der Vorgang der Fällung wird Zementation genannt. Das erhaltene Kupfer ist oft verunreinigt.[26] Die Fällung von Kupfer auf Eisen aus natürlich vorkommenden Metallsalz-Lösungen wurde in China bereits seit 1086 n. Chr. praktiziert.[27]
Kupfer kann auch durch eine aluminothermische Reaktion dargestellt werden. Als Thermit dient hierbei ein Gemisch aus Kupfer(II)-oxid und Aluminiumgrieß. Durch den Einsatz eines Fließmittels (z. B. Calciumfluorid) kann die Ausbeute erhöht werden, weil sich die elementaren Metalle nicht, die entstehende Schlacke aber im Fließmittel lösen kann. Die aluminothermische Gewinnung ist wegen des dafür nötigen Aluminiums nicht wirtschaftlich.
-
Gerösteter Kupferkies, sogenannter Kupferstein
-
Entkupferung von Erzlösung über Eisenplatten durch Bildung von „Zementkupfer“ (hellrosa)
-
Verwendete Verfahren zur Kupfergewinnung (1930–1995)
Eigenschaften
Physikalische Eigenschaften


Mit einer Dichte von 8920 kg/m³ gehört Kupfer zu den Schwermetallen, das kubisch-flächenzentriert kristallisiert und damit eine kubisch dichteste Kugelpackung mit der Raumgruppe Fm3m (Raumgruppen-Nr. 225) aufweist. Der Gitterparameter beträgt bei reinem Kupfer 0,3615 nm[28] (entspricht 3,615 Å) bei 4 Formeleinheiten pro Elementarzelle.[29]
Kupfer ist ein sehr guter Wärmeleiter. Sein Schmelzpunkt liegt bei 1083,4 °C. Ebenso ist Kupfer ein sehr guter elektrischer Leiter mit einer elektrischen Leitfähigkeit von 58 · 106 S/m. Seine Leitfähigkeit ist nur wenig schlechter als Silber und deutlich besser als Gold. Da alle im Kupfer gelösten Beimengungen, besonders Verunreinigungen wie Phosphor und Eisen[30] die Leitfähigkeit stark herabsetzen, werden für Leiterwerkstoffe oft höchste Reinheitsgrade angestrebt.
Die Mohshärte von Kupfer beträgt 2,5 bis 3, was einer Vickershärte (VHN) von 77–99 bei einer Prüfkraft von 100 g entspricht. Durch Kaltumformung wird die Festigkeit von 150…200 MPa (Gusszustand) auf Werte um 450 MPa erhöht. Die Bruchdehnung liegt dabei bei 4,5 % mit Härtewerten um 100 HB. Verformtes und anschließend weichgeglühtes Kupfer mit einer Festigkeit von 200…240 MPa hat eine Bruchdehnung größer 38 % und Härtewerte um die 50 HB.
Die Weichheit von Kupfer erklärt zum Teil die hohe elektrische Leitfähigkeit und die hohe Wärmeleitfähigkeit, die unter den reinen Metallen bei Raumtemperatur die zweithöchste nach Silber ist. Dies liegt daran, dass der spezifische Widerstand für den Elektronentransport in Metallen bei Raumtemperatur in erster Linie auf der Streuung von Elektronen bei thermischen Schwingungen des Gitters beruht, die in einem weichen Metall relativ schwach sind.[31]
Schmieden ist bei Temperaturen von 700 bis 800 °C sehr gut möglich. Kaltverformungen sind gut ohne Zwischenglühen durchführbar.
Als blankes Metall hat Kupfer eine hellrote Farbe, die Strichfarbe ist rosarot. Die rote Farbe rührt daher, dass es bei normaler Temperatur das komplementäre grüne und blaue Licht etwas mehr absorbiert. An der Luft läuft es an und wird zunächst rotbraun. Bei weiterer Verwitterung und Korrosion geht sehr langsam (oft über Jahrhunderte) die glatte Oberfläche verloren und die Farbe verändert sich durch die Bildung einer Patina von rotbraun zu blaugrün.
Kupfer ist eines der wenigen metallischen Elemente mit einer anderen natürlichen Farbe als Grau oder Silber.[32] Reines Kupfer ist orangerot und verfärbt sich an der Luft rötlich. Die charakteristische Farbe von Kupfer ergibt sich aus den elektronischen Übergängen zwischen der gefüllten 3d- und der halb leeren 4s-Atomhülle – der Energieunterschied zwischen diesen Hüllen entspricht orangefarbenem Licht.
Wie bei anderen Metallen tritt galvanische Korrosion auf, wenn Kupfer mit einem anderen Metall in Kontakt gebracht wird.[33]
Chemische Eigenschaften
| Oxidationszustände von Kupfer | |
|---|---|
| +1 | CuCl, Cu2O, CuH, Cu2C2 |
| +2 | CuCl2, CuO, CuSO4, Kupfer(II)-acetat |
| +3 | KCuO2, K3CuF6 |
| +4 | Cs2CuF6 |
Kupfer tritt in den Oxidationsstufen 0, +1, +2, +3 und +4 auf, am häufigsten sind +1 und +2, wobei +2 die stabilste Oxidationsstufe in wässrigen Lösungen ist; Stufe +4 ist extrem selten (beispielsweise in Cs2CuF6). Kupfer(II)-Salze (z. B. Kupfersulfat) sind meist von blauer oder grüner Farbe. Kupfer hat chemisch manche ähnliche Eigenschaften wie die in der gleichen Gruppe stehenden Elemente Silber und Gold. So scheidet sich an einem Eisennagel, der in eine Lösung aus Kupfersulfat getaucht wird, eine Schicht aus metallischem Kupfer ab, wofür Eisen als Eisensulfat in Lösung geht, weil Eisen unedler als Kupfer ist (siehe dazu auch Spannungsreihe). Kupfer wird von Salzsäure normalerweise nicht angegriffen,[34] bei Anwesenheit von Sauerstoff jedoch stark angegriffen, von heißer Schwefelsäure wird es aufgelöst.[35] Es löst sich auch in Salpetersäure[36] und Königswasser auf.[37] Eine Mischung aus Salzsäure oder Schwefelsäure mit Wasserstoffperoxid löst Kupfer sehr schnell auf. Das Metall wird auch von organischen Säuren angegriffen. Gegen Laugen verhält es sich stabil. Bei Rotglut reagiert es mit Sauerstoff und bildet eine dicke Schicht aus Kupferoxid. Kupfer wird von Fluor und seinen Verbindungen passiviert. Abhängig von der Korngröße ist Kupferpulver entzündbar oder brennbar. Das Metall in kompakter Form ist nicht brennbar und wird nach Ausbildung einer dünnen Oxidschicht von Luft und Wasser nicht weiter angegriffen, ist also gegen saubere Luft und Wasser beständig.[11]
In flüssigem Kupfer lösen sich Sauerstoff und Wasserstoff, die sich bei der Erstarrung der Schmelze zu Wasserdampf umsetzen können und damit die Ursache für Gasporosität im Gussstück bilden.
In sauerstoffhaltigen Kupfersorten können beim Kontakt mit wasserstoffhaltigen Gasen Risse und Hohlräume entstehen, was zu der sogenannten Wasserstoffversprödung bei Kupfer führt.
Biologische Eigenschaften
Im Vergleich zu vielen anderen Schwermetallen ist Kupfer für höhere Organismen nur relativ schwach giftig. So kann ein Mensch täglich 0,04 Gramm Kupfer zu sich nehmen, ohne Schaden an seiner Gesundheit zu erleiden.[38] In freier, nicht an Proteine gebundener Form wirkt Kupfer antibakteriell; man spricht hier, wie beim Silber, vom oligodynamischen Effekt, weshalb z. B. auch Blumenwasser, das in Kupfergefäßen aufbewahrt wird oder in das eine Kupfermünze gelegt wird, nicht so schnell faulig wird.
Bakterizide Eigenschaften
Kupfer ist für viele Mikroorganismen bereits in geringen Konzentrationen toxisch. Daher (aber auch weil leicht verlegbar) sind Wasserendleitungen oft kupferhaltig. Aufgrund der bakteriziden Eigenschaft von Kupfer wird in Großversuchen getestet, ob es wirtschaftlich sinnvoll ist, Krankenhauszimmer mit kupferbeschichteten Türklinken auszustatten. So belegt eine Klinische Studie von 2008/2009, dass in der Asklepios-Klinik Wandsbeck, Hamburg, nach dem Austausch von 50 Türgriffen/-platten und Lichtschaltern die MRSA-Keime auf 63 % reduziert wurden.[39][40] Eine Studie aus Chile stellte bei einer Luftfeuchte von 7,2 bis 19,7 % eine Reduktion der Keimzahlen auf Gegenständen aus Kupferlegierungen um bis zu 92 % fest. Eine Multicenterstudie von 2010/2011 aus den USA belegt, dass die Infektionsrate in „Kupferzimmern“ um annähernd 60 % sinkt, auf den Kupfergegenständen selbst um über 80 %. 2013 rüstete die Klinik für Kinder- und Jugendmedizin im Klinikum Niederberg, Nordrhein-Westfalen, auf Kupferlegierungen um.[41]
Die toxische Wirkung entsteht dadurch, dass Kupferionen sich an Thiolgruppen von Proteinen binden und Lipide der Zellmembran peroxidieren, was zur Bildung von freien Radikalen führt, welche die DNA und Zellmembranen schädigen. Beim Menschen führt das beispielsweise im Fall von Morbus Wilson (Kupferspeicherkrankheit) zu Schädigungen der Organe mit einem hohen Kupferüberschuss.[42]
Kupferlegierungen mit einem Kupferanteil von mindestens 60 % zeigen auch eine toxische Wirkung gegenüber Noroviren.[43]
Wirkung gegen Schnecken
Durch den Schneckenschleim wird das Kupfer im Kupferdraht oder Kupferfolie oxidiert, die als Barriere zu gefährdeten Pflanzen dient. Dadurch entsteht eine reizende Substanz, die die Schnecke daran hindert, weiter zu kriechen.[44][45]
Biologischer Kupferbedarf
Bei den meisten Mehrzellern ist Kupfer Bestandteil vieler Enzyme (Metalloenzyme) und daher ein lebensnotwendiges Spurenelement. Kupfer ist Bestandteil des blauen Hämocyanin, das bei Weichtieren und Gliederfüßern als Blutfarbstoff dem Sauerstofftransport dient.
Der tägliche Bedarf eines erwachsenen Menschen beträgt 1,0–1,5 Milligramm.[46] Im menschlichen Körper wird Kupfer hauptsächlich in der Leber gespeichert.
Kupfer ist vor allem in Schokolade, Leber, Getreide, Gemüse und Nüssen enthalten. Kupfermangel tritt beim Menschen selten auf, hauptsächlich bei langanhaltenden Durchfällen, frühreifen Kindern, nach einer langanhaltenden Unterernährung oder Malabsorption durch Krankheiten wie z. B. Sprue, Morbus Crohn oder Mukoviszidose. Die Einnahme hoher Dosen von Zink, Eisen oder Molybdat kann ebenfalls zu verringerten Kupfermengen im Körper führen.[47] Das Menkes-Syndrom ist eine seltene angeborene Kupferstoffwechselstörung.[48][49]
Kupferüberschuss und Vergiftung

Überschüssiges Kupfer wird mit der Gallenflüssigkeit zur Ausscheidung in das Verdauungssystem abgegeben.[47]
Kupfersulfat (Kupfervitriol) ist ein starkes Brechmittel und wurde deshalb zur Behandlung vieler Vergiftungen eingesetzt, beispielsweise durch weißen Phosphor, was in diesem speziellen Fall auch noch den Vorteil hat, dass gleichzeitig der Phosphor als schwerlösliches Kupferphosphid gebunden wird.
Bei der seltenen Erbkrankheit Morbus Wilson ist die Kupferausscheidung beeinträchtigt und es kommt zu vermehrter Kupferanlagerung, zuerst in der Leber, dann, wenn diese das Kupfer in den Blutkreislauf ausscheidet, auch in anderen Organen. Eine weitere ebenso seltene Erkrankung des Kupferstoffwechsels ist das Menkes-Syndrom. Dabei kann das Kupfer von den Zellen zwar aufgenommen, dann aber nicht mehr geordnet weitertransportiert werden, so dass einige Organe einen erhöhten, andere wiederum einen erniedrigten Kupfergehalt aufweisen.
Kupfer und Morbus Alzheimer
Immer wieder wurde der Zusammenhang zwischen Kupfer und der Entstehung der Alzheimer-Krankheit diskutiert. Bereits 2003 vermuteten Forscher, dass Kupfer die Produktion von Amyloid A bremst und ein Mangel an Kupfer die Alzheimerdemenz fördert.[50] Eine darauf folgende Pilotstudie mit 70 Alzheimer-Patienten konnte jedoch keine protektive Wirkung von einer erhöhten Kupfer-Einnahme zeigen, auch wenn es zu einer Stabilisierung im Abfall von Abeta42 im Liquor kam, einem Krankheitsmarker der Alzheimer-Erkrankung.[51]
Andere Studien zeigten, dass Kupfer für das Gehirn schädlich sein könnte. So zeigte eine Studie mit dem Ionophor PBT2 als Wirkstoff gegen Alzheimer gute Ergebnisse in einer Phase-II-Studie. Der Wirkstoff bindet nicht nur Zink, sondern auch Kupfer und verringert somit die Konzentration von Kupfer im Gehirn.[52]
Eine neue Studie zeigt, dass Kupfer sich bei langfristiger hoher Zufuhr in den Hirnkapillaren ablagert und dort die Blut-Hirn-Schranke schädigen kann. Dadurch wird der Abtransport von Beta-Amyloid behindert, die Akkumulation des Stoffes verursacht dann den Morbus Alzheimer.[53]
Verwendung



Kupfer wird rein oder als Legierung in der Elektroinstallation, für Rohrleitungen (Heizung, Wasser, Gase), für Präzisionsteile, Münzen, Essbesteck, Kunstgegenstände, Musikinstrumente und vieles mehr verwendet.
Wird es in Kontakt mit anderen Metallen eingesetzt, führt es bei diesen bei Feuchtigkeitseinfluss zu Kontaktkorrosion.
Nach Silber besitzt Kupfer noch vor Gold die zweithöchste elektrische Leitfähigkeit aller Stoffe und wird daher u. a. eingesetzt für:
- elektrische Leitungen, Schaltdrähte und Stromkabel geringen Querschnitts, Oberleitungen
- Leiterbahnen auf Leiterplatten und teilweise in integrierten Schaltkreisen
- Elektrische Maschinen: Drahtwicklungen in Transformatoren, Drosseln/Spulen und Elektromotoren
- Bauteile: Anodenkörper von Magnetrons, Klemmen, Bauteilanschlussbeine, Kontaktträger, Presshülsen
Aluminium ist zwar billiger und auf die Masse pro Länge bezogen ein besserer elektrischer Leiter als Kupfer. Es ist aber voluminöser. U. a. deshalb und auch weil Kupfer besser kontaktiert werden kann und es eine höhere Biegewechselbeständigkeit hat, wird es als Stromleiter gegenüber Aluminium meist bevorzugt, außer wenn es auf das Gewicht oder den Preis ankommt.
Drähte und Litzen aus sogenanntem Oxygen Free Copper (OFC, englisch für Sauerstoff-freies Kupfer mit einer Reinheit von > 99,99 %) haben ein sehr feinkörniges Kristallgefüge und eine besonders hohe Ermüdungsbruchfestigkeit. Sie werden für mechanisch hochbeanspruchte Kabel und Leitungen eingesetzt.
Für Oberleitungen werden Legierungen von Kupfer und Magnesium verwendet[54]. Dabei muss ein Kompromiss zwischen steigender Zugfestigkeit und sinkender Leitfähigkeit gefunden werden.
Kupfer besitzt ein hohes Reflexionsvermögen im Infrarotbereich und wird daher als Spiegel für Kohlendioxidlaser-Strahlen und zur Glasbeschichtung (Isolierglas) eingesetzt.
Wegen seiner hohen Wärmeleitfähigkeit und Korrosionsbeständigkeit eignet es sich gut als Material für Wärmetauscher, Kühlkörper und Montageplatten von Leistungshalbleitern.
Im Kunsthandwerk wird Kupferblech getrieben, das heißt durch Hämmern verformt, was aufgrund seiner Weichheit leicht möglich ist. In der bildenden Kunst wird Kupfer bis heute zur Fertigung von Druckplatten für Kupferstiche und Radierungen verwendet.
Auch Dächer werden mit Kupferblech gedeckt, worauf sich dann eine beständige grünliche Patina bildet, die aus verschiedenen basischen Kupferhydroxiden bzw. Kupfercarbonaten besteht. Diese oft fälschlich auch als „Grünspan“ (siehe Kupferacetat) bezeichnete Patina schützt das darunterliegende Metall gut vor weiterer Korrosion, sodass Kupferdächer eine Lebensdauer von mehreren Jahrhunderten haben können. Kupfernägel finden beim traditionellen Schieferdach Verwendung.
Legierungen
Kupfer ist auch Bestandteil vieler Legierungen wie z. B. Messing (mit Zink), Bronze (mit Zinn) und Neusilber (mit Zink und Nickel). Diese Kupferlegierungen werden wegen ihrer guten Eigenschaften, wie Farbe, Korrosionsbeständigkeit und Verarbeitbarkeit gerne vielfältig eingesetzt. Man unterscheidet Knetlegierungen (Messing und Neusilber) und Gusswerkstoffe (Rotguss, Bronzen): Knetlegierungen werden durch plastisches Umformen (Warmumformen: Walzen, Schmieden usw. oder Kaltumformen: Drahtziehen, Hämmern, Kaltwalzen, Tiefziehen usw.) in die gewünschte Form gebracht, während Gusswerkstoffe meist nur schwer oder gar nicht plastisch formbar sind.
Je nach Nickelzusatz verschwindet die kupfereigene Farbe und es entstehen gelbliche bis weiße korrosionsfeste Legierungen (Kupfernickel).
Viele Münzwerkstoffe sind auf Kupferbasis hergestellt, so ist das „Nordisches Gold“ genannte Metall der goldfarbigen Teile der Euromünzen eine Kupfer-Zink-Aluminium-Zinn-Legierung. Die Münzmetalle der bis 2001 gültigen 1-DM-Geldstücke sowie die hellen Anteile der Euromünzen bestehen aus Kupfernickel-Legierungen.
Kupferverbindungen kommen in Farbpigmenten, als Toner, in medizinischen Präparaten und galvanischen Oberflächenbeschichtungen zum Einsatz.
Nachweis

Kupfer färbt die Boraxperle in der oxidierenden Flammenzone blau bis blau-grün, in der reduzierenden Flammenzone ist keine Färbung bemerkbar bzw. wird die Perle rot bis rotbraun gefärbt. Im klassischen Kationentrenngang wird Kupfer in der Schwefelwasserstoff-Gruppe gefällt und dort in der Kupfergruppe als blauer Komplex nachgewiesen. Letztere Färbung beruht darauf, dass Lösungen von Kupfer(II)-Ionen mit Ammoniak einen tiefblauen Kupfertetramminkomplex, [Cu(NH3)4]2+, bilden (siehe auch Komplexbildungsreaktion).
Eine Kaliumhexacyanoferrat(II)-Lösung fällt Kupfer(II)-Ionen als Kupfer(II)-hexacyanoferrat(II), Cu2[Fe(CN)6]. Diese Nachweisreaktion ist sehr empfindlich, d. h., sie zeigt auch geringe Kupfermengen an.
Kupfersalze färben die Flamme (Bunsenbrennerflamme) grün bis blau (Flammenfärbung, Spektralanalyse).
Die quantitative Bestimmung kann durch Elektrogravimetrie an einer Platinnetzkathode aus einer schwefelsauren Kupfer(II)-haltigen Lösung erfolgen. Maßanalytisch kann Kupfer durch Iodometrie oder Komplexometrie (Titration mit Titriplex/Komplexon III mit Indikator Murexid) bestimmt werden. Im Spurenbereich steht die Differenzpulspolarographie zur Verfügung (Halbstufenpotential −0,62 V gegen SCE in 1 M Thiocyanat-Lösung). Ultraspuren an Kupfer bestimmt man mittels Inversvoltammetrie,[55] Graphitrohr-AAS oder ICP-MS.
Kupfer(II)-Ionen bilden mit Cuprizon (Oxalsäurebiscyclohexylidenhydrazid) in schwach alkalischer Lösung einen blauen Komplex.
Verbindungen
Oxide und Hydroxide

Kupfer(I)-oxid ist rötlich und besitzt eine kubische Kristallstruktur mit der Raumgruppe Pn3m (Raumgruppen-Nr. 224).[56] Es wird als Pigment in Glas, Keramik, Email, Porzellanlasur sowie als optisches Glaspoliermittel, Insektizid, Katalysator für die Ammoniakherstellung, Lösungsmittel für Chromeisenerze, in galvanischen Elektroden, in der Pyrotechnik, Wolkenbildung, Korrosionsinhibitoren, Galvanisierverfahren, Elektronik, Textilien, als Flammschutzmittel, Kraftstoffadditiv, Katalysator zur Schadstoffbekämpfung, Drucken und Fotokopieren und als Holzschutzmittel verwendet.
Kupfer(II)-oxid ist ein schwarzer, amorpher oder kristalliner Feststoff und bildet eine monokline Kristallstruktur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15).[56] Es wird in der Keramikindustrie verwendet, um Gläser, Glasuren und Emails blau, grün oder rot zu färben. Es wird gelegentlich zur Einarbeitung in Mineralstoffzusätze zur Absicherung gegen Kupfermangel in der Tierernährung eingesetzt. Zu seinen weiteren Anwendungen gehört die Aufbereitung von Lösungen für die Zellstoffindustrie.
Kupfer(II)-hydroxid ist blau und wird zur Herstellung von Zellstoff, Batterieelektroden und anderen Kupfersalzen verwendet. Es wird als Beizmittel beim Färben, als Pigment- und Futtermittelzusatz, bei der Behandlung der Lagerfäule bei Preiselbeeren und als Fungizid gegen bakterielle Schwachstellen bei Salat, Pfirsichen, Preiselbeeren und Walnüssen verwendet.[57]
Halogenide
Kupfer(II)-chlorid ist ein braunes, stark hygroskopisches Pulver. Es wird als Katalysator für organische und anorganische Reaktionen, Beizmittel zum Färben und Bedrucken von Textilien, Pigment für Glas und Keramik, Holzschutzmittel, Desinfektionsmittel, Insektizid, Fungizid und Herbizid sowie als Katalysator bei der Herstellung von Chlor aus Chlorwasserstoff verwendet. Kupfer(II)-chlorid-Dihydrat (CuCl2 · 2 H2O) ist ein blaugrüner Feststoff.
Kupfer(I)-chlorid ist weiß und besitzt eine Kristallstruktur vom Zinkblende-Typ mit der Raumgruppe F43m (Raumgruppen-Nr. 216).[58] Es wird als Katalysator für viele organische Reaktionen verwendet. Ammoniaklösungen von Kupfer(I)-chlorid werden zur Reinigung von Gasen von Kohlenstoffmonoxid eingesetzt.[57]
Weitere anorganische Verbindungen

Kupfersulfat kommt in der Natur als als Chalkanthit (Kupfersulfat-Pentahydrat, Cu[SO4] · 5H2O) und als Boothit (Kupfersulfat-Heptahydrat, Cu[SO4] · 7H2O) vor. Es dient zum Konservieren von Häuten, zum Gerben von Leder, zur Herstellung von Kupfersalzen, zum Konservieren von Zellstoffholz und gemahlenem Zellstoff, zur Bekämpfung des Algenwachstums in stehenden Gewässern. Außerdem wird es in Galvaniklösungen, Wasch- und Metallmarkierungsfarben, Erdölraffinerien, in der Pyrotechnik und für viele andere industrielle Anwendungen eingesetzt.[57]
Organische Verbindungen

Kupfer(II)-acetat (Grünspan) bildet dunkelgrüne Kristalle. Es wird als Fungizid, Katalysator für organische Reaktionen, Pigment für Keramiken, Insektizid, Schimmelschutzmittel, Konservierungsmittel für Cellulosematerialien, Stabilisator für Polyurethane und Nylons, Korrosionsschutzmittel und Kraftstoffadditiv verwendet.[57]
Preisentwicklung

Kupfer ist ein relativ teures Metall. Sein Preis entsteht maßgeblich an den großen Rohstoffbörsen und Warenterminbörsen der Welt. Führend im Kupferhandel ist die London Metal Exchange (LME).[59]
Der Weltmarktpreis für Kupfer unterliegt starken Schwankungen: Die größte Schwankung erfuhr er in den letzten 10 Jahren im Jahre 2008, als der Preis für Kupfer am 2. Juli an der LME noch zum zwischenzeitlichen Höchststand von 8.940 USD/t[60] gehandelt wurde und bis zum 23. Dezember 2008 auf seinen 10-Jahres-Tiefststand von 2.825 USD[60] fiel. Danach erholte sich der Kupferpreis in weniger als 4 Monaten (15. April 2009) wieder bis auf 4.860 USD/t.[60] Seinen 10-Jahres-Höchststand hatte der Kupferpreis am 14. Februar 2011 mit 10.180 USD/t.[61]
Von März 2012 bis März 2013 stieg der Kupferpreis in der Spitze (2. April 2012) bis auf 8.619,75 USD und am 2. August 2012 bis auf 7.288,25 USD.[62] Eine ähnliche Spannweite zeigte sich auch von Oktober 2012 bis März 2013 zwischen 8.350 USD/t und 7.577 USD/t.[63]
Im August 2014 lag der Weltmarktpreis für Kupfer bei etwa 7.000 USD/t.[64] Dies waren nach damaligem Wechselkurs 6.494 EUR/t.[65]
Der hohe Kupferpreis bedingt auch einen Anstieg der Diebstähle von kupferhaltigen Gegenständen. Besonders betroffen sind hier Erdungskabel von Eisenbahnen. Beispielsweise entstanden der Deutschen Bahn AG im Jahr 2015 rund 14 Mio. Euro Schaden.[66]
Einer der größten Finanzskandale der neueren Geschichte ist die Sumitomo-Affäre. Sie beruhte auf dem Handel mit Kupfer. In Folge der Aufdeckung sank 1996 der Kupferpreis innerhalb eines Tages um 27 %.
Literatur
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- J. W. Howard: The story of copper. In: Journal of Chemical Education. Band 6, Nr. 3, 1929, S. 413–431, doi:10.1021/ed006p413 (PDF).
Weblinks
- Mineralienatlas:Kupfer (Daten), Mineralienatlas:Mineralienportrait/Kupfer (Geschichte, Verhüttung etc.)
- deutschlandfunk.de, Das Feature, 18. Juli 2017, Michael Faulmüller: Kupfer – Element der Zwietracht: Eine Geschichte vom ewigen Kampf
- kupfer-institut.de (Deutsches Kupferinstitut DKI)
- London Metal Exchange, lme.com: Kupferpreis
Anmerkungen
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Kupfer) entnommen.
Einzelnachweise
- ↑ a b Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ CIAAW, Standard Atomic Weights Revised 2013.
- ↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1509.
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ A. Lossin: Copper. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a07_471.
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, 2005, ISBN 3-11-017485-5, S. 361.
- ↑ Buildingmaterials.de: Kupfer ( vom 15. November 2009 im Internet Archive)
- ↑ Baustoffsammlung der Fakultät für Architektur der TU München: Metalle – Kupfer.
- ↑ Glyconet (Seite nicht mehr abrufbar, festgestellt im April 2019. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis..
- ↑ a b c Eintrag zu Kupfer in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte
- ↑ Wilhelm Hassenstein: Das Feuerwerksbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdrucks von 1529 mit Übertragung ins Hochdeutsche und Erläuterungen, München 1941, S. 104.
- ↑ Zu den Ochsenhautbarren, deren Verbreitung und den bronzezeitlichen Kupferhandel siehe: Serena Sabatini: Revisiting Late Bronze Age oxhide ingots. Meanings, questions and perspectives. In: Ole Christian Aslaksen (Hrsg.): Local and global perspectives on mobility in the Eastern Mediterranaean (= Papers and Monographs from the Norwegian Institute at Athens, Band 5). The Norwegian Institute at Athens, Athen 2016, ISBN 978-960-85145-5-3, S. 15–62.
- ↑ Sungmin Hong, Jean-Pierre Candelone, Clair C. Patterson, Claude F. Boutron: History of Ancient Copper Smelting Pollution During Roman and Medieval Times Recorded in Greenland Ice. In: Science. Band 272, Nr. 5259, 1996, S. 246–249 (247, Abb. 1 & 2; 248, Tab. 1)
- ↑ Deutsches Kupferinstitut – Verfügbarkeit von Kupfer
- ↑ a b Fundortliste für gediegen Kupfer beim Mineralienatlas und bei Mindat
- ↑ IMA/CNMNC List of Mineral Names; July 2019 (PDF 1,67 MB; Kupfer (Copper) siehe S. 44)
- ↑ IMA/CNMNC List of Mineral Names – Copper (englisch, PDF 1,8 MB, S. 64)
- ↑ Webmineral – Minerals Arranged by the New Dana Classification. 01.01.01 Gold group
- ↑ Copper. In: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Hrsg.): Handbook of Mineralogy, Mineralogical Society of America. 2001 (handbookofmineralogy.org [PDF; 58 kB; abgerufen am 22. Januar 2018]).
- ↑ Mineralienatlas:Kupfer
- ↑ Webmineral – Mineral Species sorted by the element Cu (Copper) (englisch).
- ↑ Weltkulturerbe Cornish Mining ( des vom 17. Februar 2011 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- ↑ United States Geological Survey: World Mine Production and Reserves
- ↑ Die nachstehende Seite ist nicht mehr abrufbar, festgestellt im Juni 2017. (Suche in Webarchiven.) Kupfer und Waren daraus.
- ↑ T. N. Lung: The history of copper cementation on iron — The world's first hydrometallurgical process from medieval China. In: Hydrometallurgy. Volume 17, Issue 1, November 1986, S. 113–129; doi:10.1016/0304-386X(86)90025-3.
- ↑ Ralph W. G. Wyckoff: Crystal Structures. 2. Auflage. Band 1. John Wiley & Sons, New York, London, Sydney 1963, S. 3 (im Anhang).
- ↑ Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. Chemical-structural Mineral Classification System. 9. Auflage. E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 34.
- ↑ H. Keller,K. Eickhoff: Kuper und Kupferlegierungen, Springer-Verlag 2013, 54 Seiten, Seite 7
- ↑ George L. Trigg, Edmund H. Immergut: Encyclopedia of applied physics. 4: Combustion to Diamagnetism. VCH Publishers, 1992, ISBN 978-3-527-28126-8, S. 267–272 (google.com [abgerufen am 2. Mai 2011]).
- ↑ William Chambers, Robert Chambers: Chambers's Information for the People. 5th Auflage. Band L. W. & R. Chambers, 1884, ISBN 978-0-665-46912-1, S. 312 (google.com).
- ↑ Galvanic Corrosion. In: Corrosion Doctors. Abgerufen am 29. April 2011.
- ↑ Universität Siegen: Reaktion von Metallen mit Salzsäure.
- ↑ Fakten zum Thema – Schwefelsäure ( vom 8. März 2001 im Internet Archive)
- ↑ Universität Siegen: Reaktion von Metallen mit Salpetersäure.
- ↑ eLexikon Chemie: Kupferchlorid.
- ↑ Tägliche Aufnahme von 0,5 mg/kg unbedenklich laut: A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1434.
- ↑ Jens Oliver Bonnet: Kupfer gegen Keime: Erwartungen wurden übertroffen. Asklepios Kliniken Hamburg GmbH, Pressemitteilung vom 16. Juni 2009 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 15. September 2015.
- ↑ Keimkiller Kupfer – Thema zu „wissen aktuell: Die Macht der Zellpiraten“.
- ↑ Im Klinikalltag angekommen?Antimikrobielle Konstruktionswerkstoffe auf Basis masiven Kupfers, auf krankenhaushygiene.de
- ↑ A. Ala, A. P. Walker, K. Ashkan, J. S. Dooley, M. L. Schilsky: Wilson’s disease. In: The Lancet. Band 369, Nummer 9559, Februar 2007, S. 397–408, doi:10.1016/S0140-6736(07)60196-2. PMID 17276780.
- ↑ S. L. Warnes, C. W. Keevil: Inactivation of norovirus on dry copper alloy surfaces. In: PLoS One. 8(9), 2013, e75017. PMID 24040380, PMC 3767632 (freier Volltext, PDF).
- ↑ ratschlag24.com: Kupferdraht gegen Schneckenplage. ( vom 11. April 2013 im Webarchiv archive.today) 17. März 2008.
- ↑ sat1.de: Sendung 24: clever! - Wissensbuch ( vom 26. Mai 2011 im Internet Archive).
- ↑ med.de: Eintrag zu Kupfer, abgerufen am 23. Februar 2013.
- ↑ a b Merck Manual: Copper.
- ↑ J. F. Mercer: Menkes syndrome and animal models. In: The American journal of clinical nutrition. Band 67, Nummer 5 Suppl, Mai 1998, S. 1022S–1028S. PMID 9587146. (Review).
- ↑ S. Lutsenko, N. L. Barnes u. a.: Function and regulation of human copper-transporting ATPases. In: Physiological reviews. Band 87, Nummer 3, Juli 2007, S. 1011–1046, doi:10.1152/physrev.00004.2006. PMID 17615395. (Review).
- ↑ T. A. Bayer: Dietary Cu stabilizes brain superoxide dismutase 1 activity and reduces amyloid Aβ production in APP23 transgenic mice. In: Proceedings of the National Academy of Sciences. 100, 2003, S. 14187–14192, doi:10.1073/pnas.2332818100.
- ↑ Holger Kessler, Frank-Gerald Pajonk, Daniela Bach, Thomas Schneider-Axmann, Peter Falkai, Wolfgang Herrmann, Gerd Multhaup, Jens Wiltfang, Stephanie Schäfer, Oliver Wirths, Thomas A. Bayer: Effect of copper intake on CSF parameters in patients with mild Alzheimer’s disease: a pilot phase, 2 clinical trial. In: Journal of Neural Transmission. 115, 2008, S. 1651–1659, doi:10.1007/s00702-008-0136-2.
- ↑ N. G. Faux, C. W. Ritchie, A. Gunn, A. Rembach, A. Tsatsanis, J. Bedo, J. Harrison, L. Lannfelt, K. Blennow, H. Zetterberg, M. Ingelsson, C. L. Masters, R. E. Tanzi, J. L. Cummings, C. M. Herd, A. I. Bush: PBT2 rapidly improves cognition in Alzheimer's Disease: additional phase II analyses. In: Journal of Alzheimer's disease : JAD. Band 20, Nummer 2, 2010, S. 509–516, doi:10.3233/JAD-2010-1390. PMID 20164561.
- ↑ I. Singh, A. P. Sagare, M. Coma, D. Perlmutter, R. Gelein, R. D. Bell, R. J. Deane, E. Zhong, M. Parisi, J. Ciszewski, R. T. Kasper, R. Deane: Low levels of copper disrupt brain amyloid-β homeostasis by altering its production and clearance. In: Proceedings of the National Academy of Sciences. S. , doi:10.1073/pnas.1302212110.
- ↑ Deutsches Kupferinstitut: Kupfer und seine Anwendungen ( des vom 16. Juli 2012 im Webarchiv archive.today) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- ↑ R. Neeb: Inverse Polarographie und Voltammetrie. Akademie-Verlag, Berlin 1969, S. 185–188.
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 979.
- ↑ a b c d National Pollutant Inventory: Copper and compounds
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 973.
- ↑ Führend im Handel mit Kupfer: London Metal Exchange – LME Copper. Abgerufen am 15. März 2013.
- ↑ a b c Entwicklung des Kupferpreises an der London Metal Exchange in der Zeit vom 2. Juli 2008 bis 15. April 2009 ( des vom 12. August 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Quelle: Handelsblatt-Datenbank. Abgerufen am 15. März 2013.
- ↑ Höchster Preis für Kupfer an der London Metal Exchange in den letzten 10 Jahren am 14. Februar 2011 Quelle: Handelsblatt. Abgerufen am 15. März 2013.
- ↑ Entwicklung des Kupferpreises an der London Metal Exchange in den letzten 12 Monaten Quelle: Handelsblatt. Abgerufen am 15. März 2013.
- ↑ Entwicklung des Preises für Kupfer an der London Metal Exchange in den letzten 6 Monaten Quelle: Handelsblatt. Abgerufen am 15. März 2013.
- ↑ Aktueller Preis für Kupfer an der London Metal Exchange ( des vom 12. August 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Quelle: Handelsblatt.
- ↑ Diese Zahl wurde mit der Vorlage:Wechselkurs ermittelt.
- ↑ Buntmetalldiebstahl bei der Deutschen Bahn. Pressestelle der Deutschen Bahn, archiviert vom (nicht mehr online verfügbar) am 23. Dezember 2016; abgerufen am 22. Dezember 2016. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Feuergefährlicher Stoff
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 40
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Gruppe-11-Element
- Übergangsmetall
- Schwermetall
- Periode-4-Element
- Chemisches Element
- Wikipedia:Gesprochener Artikel
- Mineral
- Kubisches Kristallsystem
- Elemente (Mineralklasse)
- Elektrotechnischer Werkstoff
- Coenzym
- Elektrochemie
- Kupfer