Mangan
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Mangan, Mn, 25 | |||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | |||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 7, 4, d | |||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig metallisch (Stahlweiß) | |||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-105-1 | |||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.277 | |||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,085 % (14. Rang)[1] | |||||||||||||||||||||||||||||||||||||||
| Atomar[2] | ||||||||||||||||||||||||||||||||||||||||
| Atommasse | 54,938043(2)[3] u | |||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 140 (161) pm | |||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | low-spin: 139 pm, high-spin: 161 pm | |||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d5 4s2 | |||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 7.4340379(12) eV[4] ≈ 717.28 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 15.63999(7) eV[4] ≈ 1509.03 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 33.668(12) eV[4] ≈ 3248.5 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 51.21(12) eV[4] ≈ 4941 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 72.41(10) eV[4] ≈ 6987 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||
| Physikalisch[2] | ||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||
| Modifikationen | vier | |||||||||||||||||||||||||||||||||||||||
| Dichte | 7,43 g/cm3 (25 °C)[6] | |||||||||||||||||||||||||||||||||||||||
| Mohshärte | 6,0 | |||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (: Χm = 9,0 · 10−4; : = 8,2 · 10−4)[7] | |||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1519 K (1246 °C) | |||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 2373 K[8] (2100 °C) | |||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 7,35 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 225 kJ·mol−1[8] | |||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 13,2 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 5150 m·s−1 bei 293,15 K | |||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 479,5[1] J·kg−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 4,1 eV[9] | |||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 0,694 × 106 S·m−1 | |||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 7,8 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| Chemisch[2] | ||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +1, +2, +3, +4, (+5), +6, +7 | |||||||||||||||||||||||||||||||||||||||
| Normalpotential | −1,18 V (Mn2+ + 2 e− → Mn) | |||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,55 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,5 mg·m−3 (gemessen als einatembarer Staub)[11] | |||||||||||||||||||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||
Mangan [] ist ein chemisches Element mit dem Elementsymbol Mn und der Ordnungszahl 25. Im Periodensystem steht es in der 7. Nebengruppe (7. IUPAC-Gruppe), der Mangangruppe. Mangan ist ein silberweißes, hartes, sehr sprödes Übergangsmetall, das in manchen Eigenschaften dem Eisen ähnelt.
Mangan kommt in der Natur vorwiegend als Braunstein vor und wird in großen Mengen abgebaut. 90 % des abgebauten Mangans werden in der Stahlindustrie in Form von Ferromangan als Legierungsbestandteil von Stahl eingesetzt. Dabei entzieht es dem Stahl Sauerstoff und Schwefel und verbessert gleichzeitig die Durchhärtung. Wirtschaftlich wichtig ist zudem Mangan(IV)-oxid, das als Kathode in Alkali-Mangan-Batterien eingesetzt wird.
Das Element besitzt eine hohe biologische Bedeutung als Bestandteil verschiedener Enzyme. So wirkt es an einer zentralen Stelle im Photosynthese-Zyklus, wo ein Mangan-Calcium-Cluster für die Oxidation von Wasser zu Sauerstoff verantwortlich ist.
Geschichte
[Bearbeiten | Quelltext bearbeiten]
In der Natur vorkommende Manganoxide wie Braunstein sind schon lange als natürliche Pigmente bekannt und in Gebrauch. So wurden schwarze Manganoxid-Pigmente unter anderem in den etwa 17.000 Jahre alten Höhlenmalereien in den Höhlen von Ekain und Lascaux nachgewiesen.[12][13] In der Glasherstellung werden Manganverbindungen seit dem vierten Jahrhundert vor Christus im Römischen Reich eingesetzt. Dabei hat das Mangan zwei Funktionen: Wird Braunstein eingesetzt, färbt dieser das Glas intensiv braun-violett. Wird dagegen dreiwertiges Manganoxid in eisenhaltige Gläser gegeben, entfärbt es diese, indem es das grünfärbende zweiwertige Eisen zum schwach gelben dreiwertigen oxidiert, was zusammen mit dem Violett des Mangans ein graues „entfärbtes“ Aussehen ergibt.[14][15]
Die erste Gewinnung des Elements gelang wahrscheinlich 1770 Ignatius Gottfried Kaim (1746–1778), der Braunstein mit Kohlenstoff reduzierte und dabei unreines Mangan erhielt, das er Braunsteinkönig nannte. Diese Entdeckung ist jedoch nicht sehr bekannt geworden. 1774 erkannte Carl Wilhelm Scheele, dass Braunstein ein unbekanntes Element enthalten müsse, im gleichen Jahr stellte Johan Gottlieb Gahn auf Scheeles Anregung hin Mangan durch Reduktion von Braunstein mit Kohlenstoff her.[16] Als Name wurde nach der lateinischen Bezeichnung für Braunstein manganesia nigra zunächst Manganesium gewählt, nach der Entdeckung des Magnesiums jedoch wegen möglicher Verwechslungen zu Mangan(ium) abgekürzt. Braunstein wurde von Plinius wegen der Ähnlichkeit zum Magneteisen (oder magnes masculini sexus) als magnes feminei sexus (da Braunstein nicht magnetisch ist) bezeichnet, was im Mittelalter zu manganesia wurde.[17]
1839 wurde erkannt, dass Mangan die Formbarkeit von Eisen verbessert. Als 1856 Robert Forester Mushet (1811–1891) zeigte, dass durch Zusatz von Mangan eine Massenproduktion von Stahl im Bessemer-Verfahren möglich ist, wurde Mangan binnen kurzer Zeit in großen Mengen zur Stahlproduktion verwendet.[18] Auch Braunstein erlangte ab 1866 technische Bedeutung, als Walter Weldon das Weldon-Verfahren zur Chlorherstellung entwickelt hatte, bei dem Salzsäure mithilfe von Braunstein zu Chlor oxidiert wird.[19]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Mangan ist auf der Erde ein häufiges Element, in der kontinentalen Erdkruste kommt es mit einem Gehalt von 0,095 %[20] ähnlich häufig wie Phosphor oder Fluor vor. Nach Eisen und Titan ist es das dritthäufigste Übergangsmetall. Dabei kommt es nicht elementar, sondern stets in Verbindungen vor. Neben Mangansilikaten und Mangancarbonat ist es vor allem in Oxiden gebunden. Häufige Minerale sind die Mineralgruppe der Braunsteine, Manganit, Hausmannit, Braunit, Rhodochrosit und Rhodonit. Mangan kommt dabei in unterschiedlichen Oxidationsstufen zwei-, drei- und vierwertig vor, mitunter, wie im Hausmannit, auch in einem einzigen Mineral.
Während viele Verbindungen des zweiwertigen Mangans leicht wasserlöslich sind, sind Verbindungen in höheren Oxidationsstufen meist schwerlöslich und auch physikalisch und chemisch stabil. Darum bilden sich Manganerze vor allem unter oxidativen Bedingungen. Obwohl sich Eisen ähnlich wie Mangan verhält und ebenfalls unter oxidativen Bedingungen vom leichtlöslichen zweiwertigen zum schwerlöslichen dreiwertigen Eisen oxidiert, gibt es nur wenige Eisen-Mangan-Mischerze. Verantwortlich hierfür ist, dass Mangan sehr viel höhere Sauerstoffkonzentrationen für die Oxidation benötigt als Eisen.[18]
Abbauwürdige Manganerze lassen sich geologisch in drei Gruppen einteilen. Der erste Typ sind Rhodochrosit-Braunit-Erze, die in präkambrischen vulkanischen Gesteinen eingeschlossen sind. Diese Erze finden sich vorwiegend um den südlichen Atlantik, etwa in Brasilien, Guyana, der Elfenbeinküste, Ghana, Burkina Faso oder im Kongo. Erze des zweiten Typs finden sich in stark oxidierten, eisen- und silikatreichen Sedimentgesteinen aus dem Proterozoikum. Die Vorkommen dieses Typs bei Hotazel in Südafrika und Corumbá in Brasilien zählen zu den größten Manganvorkommen auf der Welt. Zum dritten Typ zählen Mangan-Schiefer-Erze, die durch Sedimentation in flachen Schelfmeeren entstanden sind. Zu diesem Typ zählen unter anderem Vorkommen in Gabun, der Ukraine und weiteren Ländern um das Schwarze Meer.[18]
Etwa 75 % der bekannten Ressourcen an Mangan liegen in der Kalahari Südafrikas. Auch in der Ukraine, Brasilien, Australien, Indien, Gabun und China finden sich größere Manganvorkommen. Größte Manganförderstaaten sind Südafrika, Australien, Gabun, China und Brasilien, wobei die Weltgesamtförderung 2010 bei 18,9 Millionen Tonnen lag.[21] 2020 wurde ein größeres Vorkommen in New Brunswick in Kanada entdeckt, das auf 194 Millionen Tonnen geschätzt wird.[22]
In größeren Mengen kommt Mangan in Manganknollen vor, knollenförmigen, bis zu 20 Zentimeter großen, porösen Konkretionen von Schwermetalloxiden in der Tiefsee, die bis zu 50 % aus Mangan bestehen können. Besonders hohe Konzentrationen an Manganknollen finden sich im Pazifik südlich von Hawaii sowie im Indischen Ozean. Deren Abbau, vor allem zur Gewinnung von Kupfer, Cobalt und Nickel, wurde zeitweise intensiv untersucht, scheiterte bislang jedoch an hohen technischen Anforderungen und hohen Abbaukosten bei gleichzeitig vergleichsweise niedrigen Preisen für an Land abgebaute Metalle.[23] Hinzu kommen Bedenken wegen der Folgen eines Abbaus von Manganknollen für das Ökosystem der Tiefsee.
Einen Überblick über die globalen Abbaumengen gibt folgende Tabelle:[24]
| Land | Fördermenge (in t) | ||
|---|---|---|---|
| 2019 | 2020 | 2021 | |
| 3.259.200 | 3.356.030 | 3.278.840 | |
| 3.660 | 4.710 | 5100 | |
| 1.452.034 | 493.601 | 597.446 | |
| 1.350.000 | 1.218.000 | 1.300.000 | |
| 160 | 0 | 0 | |
| 1.780 | 1.000 | 1000 | |
| 472.700 | 530.200 | 580.000 | |
| 7.900 | 5.300 | 8000 | |
| 3.158.100 | 3.709.100 | 4.240.100 | |
| 170.600 | 202.400 | 217.900 | |
| 1.502.200 | 660.100 | 934.200 | |
| 919.640 | 839.100 | 841.600 | |
| 24.000 | 23.500 | 40.000 | |
| 50.240 | 63.580 | 93.940 | |
| 230.700 | 164.300 | 252.300 | |
| 16.600 | 13.600 | 28.500 | |
| 474.910 | 365.340 | 280.790 | |
| 232.957 | 258.045 | 220.560 | |
| 35.600 | 42.050 | 41.250 | |
| 429.000 | 254.000 | 206.100 | |
| 14.660 | 11.860 | 10.250 | |
| 1.000 | 5.850 | 22.380 | |
| 12.500 | 3.630 | 3.760 | |
| 190 | 180 | 50 | |
| 18.814 | 10.120 | 9.073 | |
| 9.290 | 8.450 | 6.600 | |
| 5.900 | 28.200 | 10.700 | |
| 1.880 | 6.580 | 4040 | |
| 6.456.400 | 6.029.368 | 7.098.396 | |
| 1.000 | 0 | 0 | |
| 2.305 | 670 | 0 | |
| 39.900 | 35.600 | 30.300 | |
| 686.100 | 698.500 | 652.300 | |
| 106.000 | 121.100 | 147.000 | |
| 11.970 | 20.000 | 56.860 | |
| Summe | 21.164.890 | 19.623.184 | 21.219.335 |
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]
Abbauwürdige Manganerze enthalten mindestens 35 % Mangan. Je nach Gehalt und enthaltenen anderen Elementen werden die Erze für verschiedene Anwendungen bevorzugt genutzt. Metallurgisch genutztes Manganerz enthält zwischen 38 und 55 % Mangan und wird im Tagebau oder im Kammerbau-Verfahren unter Tage abgebaut. Daneben gibt es battery-grade-Erz, das mindestens 44 % Mangan enthält sowie nur einen geringen Anteil an Kupfer, Nickel und Cobalt enthalten darf, damit es für die Produktion von Alkali-Mangan-Batterien geeignet ist, sowie chemical-grade-Erz, das für die Produktion von reinem Mangan und Manganverbindungen verwendet wird.[23]
Für einen Großteil der Anwendungen wird kein reines Mangan benötigt. Stattdessen wird Ferromangan, eine Eisen-Mangan-Legierung mit 78 % Mangan, gewonnen. Dieses wird durch Reduktion oxidischer Mangan- und Eisenerze mit Koks in einem elektrischen Ofen hergestellt. Eine weitere Legierung, die auf diesem Weg hergestellt wird, ist die Mangan-Eisen-Silicium-Legierung Silicomangan. Hier wird zusätzlich Quarz als Siliciumquelle in den Ofen eingebracht.[23]
Reines Mangan kann technisch nicht durch die Reduktion mit Kohlenstoff gewonnen werden, da sich hierbei neben Mangan auch stabile Carbide, insbesondere Mn7C3, bilden. Erst bei Temperaturen über 1600 °C entsteht reines Mangan, bei dieser Temperatur verdampft jedoch schon ein Teil des Mangans, so dass dieser Weg nicht wirtschaftlich ist. Stattdessen wird Mangan durch Hydrometallurgie gewonnen. Hierbei wird Manganerz oxidiert, gelaugt und einer Elektrolyse unterzogen.[25] Bei letzterer wird eine möglichst reine Mangansulfat-Lösung verwendet, die mit Edelstahl-Elektroden bei 5–7 V elektrolysiert wird. An der Kathode entsteht dabei reines Mangan, an der Anode Sauerstoff, der mit Manganionen weiter zu Mangandioxid reagiert.[23]
Zur Verringerung des Energieverbrauchs werden dem Elektrolyt kleinere Mengen Schwefel- oder Selendioxid beigesetzt.[26]
Daneben sind auch die Gewinnung von Mangan durch die Reduktion von Manganoxiden mit Aluminium (Aluminothermie) oder Silicium möglich.
| Rang | Land | Förderung | Reserven |
|---|---|---|---|
| 1 | 5500 | 230.000 | |
| 2 | 3100 | 99.000 | |
| 3 | 2300 | 65.000 | |
| 4 | 1800 | 54.000 | |
| 5 | 1200 | 110.000 | |
| 6 | 850 | 13.000 | |
| 7 | 770 | 33.000 | |
| 8 | 740 | 140.000 | |
| 9 | 510 | k. A. | |
| 10 | 220 | 5000 |
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Mangan ist ein silberweißes, hartes, sehr sprödes Schwermetall. Es schmilzt bei 1246 °C und siedet bei 2100 °C.[8] Im Gegensatz zu den meisten anderen Metallen kristallisiert Mangan bei Raumtemperatur nicht in einer dichtesten Kugelpackung oder in der kubisch-raumzentrierten Kristallstruktur, sondern in der ungewöhnlichen α-Mangan-Struktur. Insgesamt sind vier verschiedene Modifikationen bekannt, die bei unterschiedlichen Temperaturen stabil sind. Bei Raumtemperatur ist Mangan paramagnetisch, die α-Modifikation wird unter einer Néel-Temperatur von 100 K antiferromagnetisch, während β-Mangan kein solches Verhalten zeigt.[28]
Bis zu einer Temperatur von 727 °C[29] ist die α-Mangan-Struktur thermodynamisch stabil. Es hat eine verzerrte kubische Struktur mit 58 Atomen in der Elementarzelle. Die Manganatome der Struktur lassen sich in vier Gruppen mit unterschiedlichen Umgebungen und Koordinationszahlen zwischen 12 und 16 einteilen.[30] Oberhalb von 727 °C bis 1095 °C ist eine weitere ungewöhnliche Struktur, die ebenfalls kubische β-Mangan-Struktur, mit 20 Formeleinheiten pro Elementarzelle und Koordinationszahlen von 12 und 14 für die Manganatome thermodynamisch günstiger.[31] Erst oberhalb von 1095 °C kristallisiert das Metall in einer dichtesten Kugelpackung, der kubisch-flächenzentrierten Kristallstruktur (γ-Mangan, Kupfer-Typ). Diese geht bei 1133 °C schließlich in eine kubisch-innenzentrierte Struktur (δ-Mangan, Wolfram-Typ) über.[29]
| Modifikation | α-Mn[30] | β-Mn[31] | γ-Mn[32] | δ-Mn[32] |
|---|---|---|---|---|
| Struktur |  |
 |
 |

|
| Kristallsystem | kubisch | kubisch | kubisch | kubisch |
| Koordinationszahl | 16+16+13+12 | 14+12 | 12 | 8 |
| Raumgruppe | I43m (Nr. 217) | P4132 (Nr. 213) | Fm3m (Nr. 225) | Im3m (Nr. 229) |
| Gitterparameter | a = 891,1 pm | a = 631,5 pm | a = 386,3 pm | a = 308,1 pm |
| Atome pro Elementarzelle | 58 | 20 | 4 | 2 |
| berechnete Dichte | 7,463 g/cm3 | 7,24 g/cm3 | 6,33 g/cm3 | 6,238 g/cm3 |
Mangan hat von allen Metallen die geringste elektrische Leitfähigkeit.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]| Oxidationszustände von Mangan[33] | |
|---|---|
| 0 | Mn2(CO)10 |
| +1 | MnC5H4CH3(CO)3 |
| +2 | MnCl2, MnO, MnCO3, Mangan(II)-acetat |
| +3 | MnF3, Mn2O3, Mangan(III)-acetat |
| +4 | MnO2 |
| +5 | K3MnO4 |
| +6 | K2MnO4 |
| +7 | KMnO4, Mn2O7 |
Als unedles Metall reagiert Mangan mit vielen Nichtmetallen. Mit Sauerstoff reagiert kompaktes Mangan langsam und oberflächlich, feinverteiltes Mangan ist dagegen an der Luft pyrophor und reagiert schnell zu Mangan(II,III)-oxid. Auch mit Fluor, Chlor, Bor, Kohlenstoff, Silicium, Phosphor, Arsen und Schwefel reagiert Mangan, wobei die Reaktionen bei Raumtemperatur nur langsam stattfinden und erst bei erhöhter Temperatur schneller sind. Mit Stickstoff reagiert das Element erst bei Temperaturen von über 1200 °C zu Mangannitrid Mn3N2, mit Wasserstoff reagiert es nicht.[34][35]
Wie andere unedle Elemente löst sich Mangan in verdünnten Säuren unter Wasserstoffentwicklung, im Gegensatz zu Chrom ist es dabei auch nicht durch eine dichte Oxidschicht passiviert. Diese Reaktion findet langsam auch in Wasser statt. Wird es in konzentrierter Schwefelsäure gelöst, bildet sich Schwefeldioxid. In wässriger Lösung sind Mn2+-Ionen, die im Komplex [Mn(H2O)6]2+ rosa gefärbt sind, besonders stabil gegenüber Oxidation oder Reduktion. Verantwortlich hierfür ist die Bildung einer energetisch begünstigten halbgefüllten d-Schale (d5). Manganionen in anderen Oxidationsstufen besitzen ebenfalls charakteristische Farben, so sind dreiwertige Manganionen rot, vierwertige braun, fünfwertige (Hypomanganat, MnO43−) blau, sechswertige (Manganat, MnO42−) grün und siebenwertige (Permanganat, MnO4−) violett.[34][35]
Isotope
[Bearbeiten | Quelltext bearbeiten]Es sind insgesamt 28 Isotope sowie acht weitere Kernisomere des Mangans zwischen 44Mn und 72Mn bekannt. Von diesen ist nur eines, 55Mn, stabil, Mangan zählt somit zu den Reinelementen. Weiterhin besitzt 53Mn mit 3,74 Millionen Jahren eine lange Halbwertszeit. Alle weiteren Isotope weisen kurze Halbwertszeiten auf, davon 54Mn mit 312,3 Tagen die längste.[36]
Das langlebigste radioaktive Manganisotop 53Mn kommt in Spuren in der Natur vor. Es bildet sich durch Spallationsreaktionen in eisenhaltigen Felsen. Dabei reagiert 54Fe mit 3He aus der kosmischen Strahlung und es wird das kurzlebige 53Fe gebildet, das zu 53Mn zerfällt.[37]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Reines Mangan wird nur in sehr geringem Umfang genutzt. 90 % des geförderten Mangans wird als Ferromangan, Spiegeleisen oder Silicomangan in der Stahlindustrie eingesetzt. Als Legierungselement wird Mangan wie auch andere typische Legierungsmetalle eingesetzt. Der Faktor, mit dem die Legierungsanteile angegeben werden, beträgt 4. (Bei Molybdän und Vanadium beträgt er 10). Ein Stahl der Sorte 16 MnCr 5 enthält folglich 1,25 % Mangan (und 1,25 % Chrom).[38] Da Mangan sehr stabile Mangan-Sauerstoff-Verbindungen bildet, wirkt es wie Aluminium und Silicium desoxidierend und verstärkt die Wirkung dieser Elemente. Zudem verhindert es die Bildung des leicht schmelzenden Eisensulfides und wirkt dadurch entschwefelnd. Gleichzeitig wird die Löslichkeit von Stickstoff im Stahl erhöht, was die Austenit-Bildung fördert. Dies ist für viele rostfreie Stähle wichtig. Eine weitere wichtige Eigenschaft von Mangan in Stahl ist, dass es die Härtbarkeit des Stahls erhöht.[23] Allgemein wird durch Mangan im Stahl neben der Härtbarkeit und Nitrierbarkeit die Zugfestigkeit, die Streckgrenze und die Warmumformbarkeit erhöht. Während Mangan auf die Kerbschlagzähigkeit und die Korrosionsbeständigkeit keinen Einfluss hat, wird die Verschleißfestigkeit, Kaltumformbarkeit, Zerspanbarkeit, die Härtetemperatur und die Schweißbarkeit vermindert.[39]
Auch in Legierungen mit Nichteisenmetallen, insbesondere Kupferlegierungen und Aluminium-Mangan-Legierungen, wird Mangan eingesetzt. Es erhöht dabei die Festigkeit, Korrosionsbeständigkeit und Verformbarkeit des Metalls. Die Legierung Manganin (83 % Kupfer, 12 % Mangan und 5 % Nickel) besitzt, ähnlich wie Konstantan oder – noch besser – Isaohm, einen niedrigen elektrischen Temperaturkoeffizienten, d. h. der elektrische Widerstand ist nur wenig von der Temperatur abhängig. Diese Materialien werden daher vielfach in elektrischen Messgeräten verwendet.[23]
Mangan wird auch als Aktivator in Leuchtstoffen eingesetzt. Je nach Oxidationsstufe liegt die Wellenlänge des emittierten Lichts nach heutigem Wissensstand zwischen 450 und 750 nm (Mn2+) bzw. 620 und 730 nm (Mn4+). Praktische Bedeutung haben vor allem BaMgAl10O17:Eu2+,Mn2+ (grüner Emitter) und Mg14Ge5O24:Mn4+ (roter Emitter) als Leuchtstoffe in weißen LED.[40]
YInMn-Blau ist ein Mischoxid aus Yttrium-, Indium- und Manganoxiden, das ein sehr reines und brillantes Blau zeigt.
Reines Mangan wird in einer Größenordnung von etwa 140.000 Tonnen pro Jahr produziert. Es wird zu einem großen Teil für die Produktion von Spezialstählen und Aluminiumlegierungen eingesetzt. Weiterhin werden daraus Zink-Mangan-Ferrite für elektronische Bauteile hergestellt.[23]
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]
Mangan ist ein für alle Lebewesen essentielles Element und Bestandteil verschiedener Enzyme. Dort wirkt es in verschiedenen Arten unter anderem als Lewis-Säure, zur Bildung der Enzym-Struktur und in Redoxreaktionen. In manchen Bakterien wird es außerdem zur Energieerzeugung genutzt. So betreibt Shewanella putrefaciens, ein im Meer vorkommendes Bakterium, eine anaerobe Atmung mit Mn4+ als terminalem Elektronenakzeptor, das hierbei zu Mn2+ reduziert wird.[41]
Mangan spielt eine essentielle Rolle in der Photosynthese, und zwar bei der Oxidation von Wasser zu Sauerstoff im Photosystem II. Zentraler Bestandteil des Photosystems ist ein Komplex aus vier Manganatomen und einem Calciumatom, die über Sauerstoffbrücken miteinander verbunden sind, der sauerstoffproduzierende Komplex (oxygen-evolving complex, OEC). Hier wird in einem mehrstufigen Zyklus, dem Kok-Zyklus, bei dem das Mangan zwischen der drei- und vierwertigen Oxidationsstufe wechselt, durch Sonnenlicht Wasser gespalten und Sauerstoff, Elektronen sowie Protonen freigesetzt.[42]
In manganhaltigen Superoxiddismutasen, die in Mitochondrien und Peroxisomen zu finden sind,[43] wird die Reaktion von Superoxid zu Sauerstoff und Wasserstoffperoxid durch Redoxreaktionen mit zwei- und dreiwertigen Manganionen katalysiert:[44]
Dioxygenasen, durch die molekularer Sauerstoff in spezielle organische Moleküle eingebaut wird, enthalten meist Eisen, jedoch sind auch mehrere manganhaltige Dioxygenasen unter anderem aus den Bakterien Arthrobacter globoformis und Bacillus brevis bekannt. Manganperoxidase, ein in dem Pilz Phanerochaete chrysosporium entdecktes Enzym, ist eines der wenigen bekannten Enzyme, die einen Abbau von Lignin erlauben. Weiterhin ist Mangan an der Reaktion von Arginasen, Hydrolasen, Kinasen, Decarboxylasen und Transferasen wie Pyruvat-Carboxylase, Mevalonatkinase und Glycosyltransferase, sowie bestimmten Ribonukleotidreduktasen und Katalasen beteiligt.[34][44]
Mangan im menschlichen Körper
[Bearbeiten | Quelltext bearbeiten]Mangan wird vom Menschen über den Dünndarm aufgenommen und vor allem in Leber, Knochen, Nieren und der Bauchspeicheldrüse gespeichert. Im Zellinneren befindet sich das Element vor allem in Mitochondrien, Lysosomen und im Zellkern. Im Gehirn liegt Mangan an spezielle Proteine gebunden vor, hauptsächlich an der Glutamat-Ammonium-Ligase in Astrozyten.[45] Die Gesamtmenge an Mangan im menschlichen Körper beträgt etwa 10 bis 40 mg.
Bedarf
[Bearbeiten | Quelltext bearbeiten]Der tägliche empfohlene Bedarf für einen Erwachsenen liegt gemäß der Deutschen Gesellschaft für Ernährung zwischen 2,0 und 5,0 mg.[46] Die durchschnittliche Manganzufuhr in Deutschland liegt bei ca. 2,5 mg.
Mangel
[Bearbeiten | Quelltext bearbeiten]Manganmangel ist selten, bei manganarm ernährten Tieren traten Skelettveränderungen, neurologische Störungen, Defekte im Kohlenhydrat-Stoffwechsel sowie Wachstums- und Fruchtbarkeitsstörungen auf.[34]
Vorkommen in Nahrungsmitteln
[Bearbeiten | Quelltext bearbeiten]Besonders manganreiche Lebensmittel sind schwarzer Tee, Weizenkeime, Haselnüsse, Haferflocken, Sojabohnen, Leinsamen, Heidelbeeren, Aroniabeeren und Roggenvollkornbrot.[47]
Sicherheit und Toxizität
[Bearbeiten | Quelltext bearbeiten]Wie viele andere Metalle ist Mangan in feinverteiltem Zustand brennbar und reagiert mit Wasser. Zum Löschen können daher nur Metallbrandlöscher (Klasse D) oder Sand verwendet werden. Kompaktes Mangan ist dagegen nicht brennbar.[10]
Wird manganhaltiger Staub in hohen Dosen eingeatmet, wirkt er toxisch. Dabei kommt es zunächst zu Schäden in der Lunge mit Symptomen wie Husten, Bronchitis und Pneumonitis. Weiterhin wirkt Mangan neurotoxisch und schädigt das Zentralnervensystem. Dies äußert sich bei akuten Vergiftungen im Manganismus (englisch: „Manganese madness“), einer Krankheit mit Verhaltensauffälligkeiten, Halluzinationen und Psychose. Bei chronischen Vergiftungen zeigen sich Parkinson-ähnliche Symptomen wie motorischen Störungen (extrapyramidale Störungen).[48][49] Für Manganstäube existiert darum ein MAK-Wert von 0,02 mg/m3 für besonders feine Stäube, die in die Lungenbläschen eindringen können und 0,2 mg/m3 für einatembare Stäube.[10]
Erkrankungen durch Mangan oder seine Verbindungen sind in Deutschland als Nr. 1105 in die Berufskrankheitenliste aufgenommen. Eine Exposition kann bei Gewinnung, Transport, Verarbeitung und Verwendung von Mangan oder seinen Verbindungen entstehen, sofern diese Stoffe als Staub oder Rauch eingeatmet werden. Dies trifft auch für das Elektroschweißen mit manganhaltigen ummantelten Elektroden zu.[50]
Bei Haushunden kommt es bei übermäßiger Manganzufuhr zu sehr schweren Leberschäden. Dies kann beispielsweise auftreten, wenn die Tiere unkontrolliert größere Mengen eines Nahrungsergänzungsmittels fressen.[51]
Nachweis
[Bearbeiten | Quelltext bearbeiten]
Der qualitative chemische Nachweis von Manganionen kann durch Bildung von violettem Permanganat nach einer Reaktion mit Blei(IV)-oxid, Ammoniumperoxodisulfat (mit Silberionen als Katalysator) oder Hypobromit in alkalischer Lösung erbracht werden.
- Reaktion von Mangan mit Blei(IV)-oxid in saurer Lösung
Für eine Abtrennung im Rahmen des Kationentrennganges kann der sogenannte Alkalische Sturz genutzt werden, bei dem Mangan durch eine Mischung von Wasserstoffperoxid und Natronlauge zu festem Mangan(IV)-oxidhydroxid oxidiert wird und ausfällt.
- Reaktion von Mangan mit Wasserstoffperoxid und Natronlauge zu Mangan(IV)-oxidhydroxid
Weitere mögliche Nachweisreaktionen, die auch als Vorprobe genutzt werden können, sind die Phosphorsalzperle, die sich durch die Bildung von Mangan(III)-Ionen violett färbt, sowie die Oxidationsschmelze, bei der durch die Reaktion mit Nitrationen eine grüne Schmelze von Manganat(VI) (MnO42−), bei geringer Sauerstoffzufuhr auch blaues Manganat(V) (MnO43−) gebildet wird. Wird eine Säure zugesetzt, bildet sich violettes Permanganat.[52]
Quantitativ kann Mangan durch die Atomabsorptionsspektroskopie (bei 279,5 nm),[34] durch photometrische Bestimmung von Permanganat, wobei das Absorptionsmaximum bei 525 nm liegt[53] oder durch Titration bestimmt werden. Hierbei werden im manganometrischen Verfahren nach Vollhard-Wolff Mn2+-Ionen mit Permanganat titriert, wobei sich Braunstein bildet. Der Endpunkt ist an der Rosafärbung durch verbleibendes Permanganat erkennbar.[54]
Durch Zugabe von Formaldoxim-Reagens zu einer Lösung von Mangan(II)-Salzen entsteht ein orange bis rot-braun gefärbter Metallkomplex.[55]
Verbindungen
[Bearbeiten | Quelltext bearbeiten]Es sind Manganverbindungen in den Oxidationsstufen zwischen −3 und +7 bekannt. Am stabilsten sind zwei-, drei- und vierwertige Manganverbindungen, die niedrigeren Stufen sind vor allem in Komplexen zu finden, die höheren in Verbindungen mit Sauerstoff.
Sauerstoffverbindungen
[Bearbeiten | Quelltext bearbeiten]


Mit Sauerstoff bildet Mangan Verbindungen in den Oxidationsstufen +2 bis +7, wobei in den höheren Stufen +5, +6 und +7 vor allem anionische Manganate sowie Manganhalogenoxide, aber auch die grüne, ölige, explosive Flüssigkeit Mangan(VII)-oxid bekannt sind. Von Bedeutung sind überwiegend die siebenwertigen, violetten Permanganate (MnO4−), wobei vor allem Kaliumpermanganat eine wirtschaftliche Bedeutung besitzt. Dieses wird unter anderem als starkes Oxidationsmittel in organischen Reaktionen, Nachweisreaktionen im Rahmen der Manganometrie sowie medizinisch als Adstringens und Desinfektionsmittel eingesetzt. Die fünfwertigen blauen Hypomanganate (MnO43−) und sechswertigen grünen Manganate (MnO42−) sind instabiler und Zwischenprodukte bei der Permanganatherstellung. Daneben gibt es noch komplexe Permanganate wie die Hexamanganato(VII)-mangan(IV)-säure, (H3O)2[Mn(MnO4)6] · 11 H2O, eine nur bei tiefen Temperaturen stabile tiefviolette Verbindung.[56] Mangan(IV)-oxid wird vorwiegend in Alkali-Mangan-Batterien als Kathodenmaterial eingesetzt. Bei der Entladung der Batterie entstehen daraus Manganoxidhydroxid sowie Mangan(II)-hydroxid. Weiterhin sind auch noch das zweiwertige Mangan(II)-oxid, das dreiwertige Mangan(III)-oxid sowie Mangan(II,III)-oxid bekannt.
Ein weiteres Hydroxid des Mangans ist Mangan(IV)-oxidhydroxid. Aus Mangan(II)-salzen mit Natronlauge gefälltes weißes Mangan(II)-hydroxid ist allerdings unbeständig und wird durch Luftsauerstoff leicht zu Mangan(III,IV)-oxidhydroxid oxidiert.[57] Wegen der leichten Oxidierbarkeit findet Mangan(II)-hydroxid zur Sauerstofffixierung bei der Winkler-Methode eine Anwendung.
Halogenverbindungen
[Bearbeiten | Quelltext bearbeiten]Mit den Halogenen Fluor, Chlor, Brom und Iod sind jeweils die zweiwertigen Verbindungen sowie Mangan(III)- und Mangan(IV)-fluorid sowie Mangan(III)-chlorid bekannt. Entsprechende Brom- und Iodverbindungen existieren nicht, da Br−- und I−-Ionen Mn(III) zu Mn(II) reduzieren.[58] Technisch wichtigstes Manganhalogenid ist das durch Reaktion von Mangan(IV)-oxid mit Salzsäure gewinnbare Mangan(II)-chlorid, das unter anderem für die Produktion von Trockenbatterien, korrosionsbeständigen und harten Magnesiumlegierungen sowie die Synthese des Antiklopfmittels (Methylcyclopentadienyl)mangantricarbonyl (MMT) verwendet wird.[59]
Weitere Manganverbindungen
[Bearbeiten | Quelltext bearbeiten]
Mangan bildet keine bei Raumtemperatur stabile, binäre Verbindung mit Wasserstoff, lediglich Mangan(II)-hydrid konnte bei tiefen Temperaturen in einer Argon-Matrix dargestellt werden.
Es sind viele Komplexe des Mangans, vorwiegend in der Oxidationsstufe +2, bekannt. Diese liegen überwiegend als High-Spin-Komplexe mit fünf ungepaarten Elektronen und einem dementsprechend starken magnetischen Moment vor. Die Kristallfeld- und Ligandenfeldtheorie sagt hier keine bevorzugte Geometrie vorher. Entsprechend sind je nach Ligand tetraedrische, oktaedrische, quadratisch-planare oder auch dodekaedrische Geometrien von Mn2+-Komplexen bekannt. Die Komplexe zeigen durch (quantenmechanisch verbotene) d-d-Übergänge eine schwache Färbung, wobei oktaedrische Mn2+-Komplexe meist schwach rosa, tetraedrische gelb-grün gefärbt sind. Mit sehr starken Liganden wie Cyanid existieren auch Low-Spin-Komplexe mit nur einem ungepaarten Elektron und einer starken Ligandenfeldaufspaltung. Zu den Komplexen in niedrigeren Oxidationsstufen zählt Dimangandecacarbonyl Mn2(CO)10 mit der Oxidationsstufe 0 des Mangans sowie einer Mangan-Mangan-Einfachbindung. Auch weitere ähnliche Komplexe wie Mn(NO)3CO mit der niedrigsten bekannten Oxidationsstufe −3 im Mangan sind bekannt.[35]
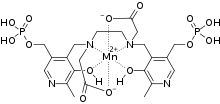
Mangafodipir ist ein leberspezifisches paramagnetisches Kontrastmittel, das für die Magnetresonanztomografie (MRT) zugelassen ist. Die kontrasterhöhende Wirkung beruht auf den paramagnetischen Eigenschaften von Mn2+-Ionen, die durch die fünf ungepaarten Elektronen bedingt sind. Die toxische Wirkung der Mn2+-Ionen wird beim Mangafodipir durch die Komplexierung mit dem Liganden Dipyridoxyldiphosphat (DPDP, bzw. Fodipir) unterdrückt. Für die Bildgebung der Leber ist es den Standard-MRT-Kontrastmitteln auf der Basis von Gadolinium überlegen.[60]
Das Metallocen des Mangans ist Manganocen. Dieses besitzt im Vergleich zu Ferrocen ein Elektron weniger und somit entgegen der 18-Elektronen-Regel nur 17 Elektronen. Trotzdem kann es wegen der günstigen High-Spin-d5-Konfiguration nicht zu Mn+ reduziert werden und liegt im Festkörper in einer polymeren Struktur vor.[61]
Eine Übersicht über Manganverbindungen bietet die Kategorie:Manganverbindung.
Literatur
[Bearbeiten | Quelltext bearbeiten]- David B. Wellbeloved, Peter M. Craven, John W. Waudby: Manganese and Manganese Alloys. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005 (doi:10.1002/14356007.a16_077).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1607–1620.
- Heinz Cassebaum: Die Stellung der Braunstein-Untersuchungen von J. H. Pott (1692–1777) in der Geschichte des Mangans. In: Sudhoffs Archiv. 63, 1979, Heft 2, S. 136–153.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Mangan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. März 2011.
- Mineralienatlas:Mangan (Wiki)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Mangan) entnommen.
- ↑ IUPAC Commission on Isotopic Abundances and Atomic Weights: Standard Atomic Weights of 14 Chemical Elements Revised. In: Chemistry International. 40, 2018, S. 23, doi:10.1515/ci-2018-0409.
- ↑ a b c d e Eintrag zu manganese in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- ↑ a b c d e Eintrag zu manganese bei WebElements, www.webelements.com, abgerufen am 11. Juni 2020.
- ↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1339.
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b c Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, 2005, ISBN 3-11-017485-5, S. 361.
- ↑ a b c d e f Eintrag zu Mangan, Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017. (JavaScript erforderlich)
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7439-96-5 bzw. Mangan und seine anorganischen Verbindungen), abgerufen am 2. November 2015.
- ↑ Emilie Chalmin, Michel Menu, Colette Vignaud: Analysis of rock art painting and technology of Palaeolithic painters. In: Measurement Science and Technology. 14, 2003, S. 1590–1597, doi:10.1088/0957-0233/14/9/310.
- ↑ E. Chalmin, C. Vignaud, H. Salomon, F. Farges, J. Susini, M. Menu: Minerals discovered in paleolithic black pigments by transmission electron microscopy and micro-X-ray absorption near-edge structure. In: Applied Physics A. 83, 2006, S. 213–218, doi:10.1007/s00339-006-3510-7.
- ↑ E. V. Sayre, R. W. Smith: Compositional Categories of Ancient Glass. In: Science. 133, 1961, S. 1824–1826, doi:10.1126/science.133.3467.1824.
- ↑ W. Patrick McCray: Glassmaking in renaissance Italy: The innovation of venetian cristallo. In: JOM – Journal of the Minerals, Metals and Materials Society. 50, 1998, S. 14–19, doi:10.1007/s11837-998-0024-0.
- ↑ E. Rancke-Madsen: The Discovery of an Element. In: Centaurus. 19, 1975, S. 299–313, doi:10.1111/j.1600-0498.1975.tb00329.x.
- ↑ Justus von Liebig, Johann C. Poggendorff, Friedrich Wöhler, Hermann Kolbe: Handwörterbuch der reinen und angewandten Chemie. Band 5, 1851, S. 594–595 (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ a b c L. A. Corathers, J. F. Machamer: Manganese. In: Society for Mining, Metallurgy and Exploration (U.S.): Industrial minerals & rocks: commodities, markets, and uses. 7. Auflage. SME, 2006, ISBN 0-87335-233-5, S. 631–636 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5, S. 182.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 85. Auflage. CRC Press, Boca Raton, Florida, 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth’s Crust and in the Sea.
- ↑ U.S. Geological Survey, Mineral Commodity Summaries 2022: MANGANESE.
- ↑ NI 43-101 Technical Report on the Woodstock Manganese Occurrence Exploration Licenses 5816 and 5745 Near Jacksonville and Irish Settlement Carlton County New Brunswick, 2020.
- ↑ a b c d e f g David B. Wellbeloved, Peter M. Craven, John W. Waudby: Manganese and Manganese Alloys. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005 (doi:10.1002/14356007.a16_077).
- ↑ Mangan. Bundesministerium für Landwirtschaft, Regionen und Tourismus Seiten 114, abgerufen am 27. Dezember 2023.
- ↑ R. Elliott, K. Coley, S. Mostaghel, M. Barati: Review of Manganese Processing for Production of TRIP/TWIP Steels, Part 1: Current Practice and Processing Fundamentals. In: JOM. 70, 2018, S. 680, doi:10.1007/s11837-018-2769-4.
- ↑ Selenium and Tellurium. ( vom 13. November 2011 im Internet Archive) (PDF; 51 kB) In: 2010 Minerals Yearbook. abgerufen am 29. Mai 2013.
- ↑ United States Geological Survey: World Mine Production and Reserves
- ↑ J. S. Kasper, B. W. Roberts: Antiferromagnetic Structure of α-Manganese and a Magnetic Structure Study of β-Manganese. In: Physical Review. 101, 1956, S. 537–544, doi:10.1103/PhysRev.101.537.
- ↑ a b K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, B30, S. 193–204, doi:10.1107/S0567740874002469.
- ↑ a b J. A. Oberteuffer, J. A. Ibers: A refinement of the atomic and thermal parameters of α-manganese from a single crystal. In: Acta Crystallographica. 1970, B26, S. 1499–1504, doi:10.1107/S0567740870004399.
- ↑ a b C. B. Shoemaker, D. P. Shoemaker, T. E. Hopkins, S. Yindepit: Refinement of the structure of β-manganese and of a related phase in the Mn-Ni-Si system. In: Acta Crystallographica. B34, 1978, S. 3573–3576, doi:10.1107/S0567740878011620.
- ↑ a b R. G. W. Wykhoff: Crystal structures. 1963, 1, S. 7–83.
- ↑ Max Schmidt: Anorganische Chemie II. Wissenschaftsverlag, 1968, S. 100–109.
- ↑ a b c d e Eintrag zu Mangan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. März 2011.
- ↑ a b c A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1608–1609.
- ↑ G. Audi, F. G. Kondev, Meng Wang, W.J. Huang, S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001, doi:10.1088/1674-1137/41/3/030001 (Volltext).
- ↑ J. Schaefer, T. Faestermann, G. Herzog, K. Knie, G. Korschinek, J. Masarik, A. Meier, M. Poutivtsev, G. Rugel, C. Schlüchter: Terrestrial manganese-53 – A new monitor of Earth surface processes. In: Earth and Planetary Science Letters. 251, 2006, S. 334–345, doi:10.1016/j.epsl.2006.09.016.
- ↑ Heinzler, Kilgus, Näher, Paetzold, Röhrer, Schilling: Tabellenbuch Metall. 37. neu bearbeitete Auflage. Europa-Lehrmittel Haan-Gruiten 1990. S. 99. Vgl. auch DIN Normenheft 3 (1983)
- ↑ Tabellenbuch, S. 104.
- ↑ Shigeo Shionoya, William M. Yen, Hajime Yamamoto (Hrsg.): Phosphor Handbook. 2. Auflage. CRC Press, Boca Raton, FL 2006, ISBN 0-8493-3564-7, S. 153ff.
- ↑ Michael T. Madigan, John M. Martinko, Thomas Lazar (Übersetzer) und Freya Thomm-Reitz (Übersetzer): Brock Mikrobiologie. 11., aktualisierte Auflage. Pearson Studium, 2009, ISBN 978-3-8273-7358-8, S. 644.
- ↑ J. Yano u. a.: Where Water Is Oxidized to Dioxygen: Structure of the Photosynthetic Mn4Ca Cluster. In: Science. 314, 2006, S. 821–825, doi:10.1126/science.1128186.
- ↑ R. G. Alscher: Role of superoxide dismutases (SODs) in controlling oxidative stress in plants. In: Journal of Experimental Botany. 53, 2002, S. 1331–1341, doi:10.1093/jexbot/53.372.1331.
- ↑ a b Neil A. Law, M. Tyler Caudle, Vincent L. Pecoraro: Manganese Redox Enzymes and Model Systems: Properties, Structures, and Reactivity. In: Advances in Inorganic Chemistry. 46, 1998, S. 305–440, doi:10.1016/S0898-8838(08)60152-X.
- ↑ A. Takeda: Manganese action in brain function. In: Brain Research Reviews. 41, 2003, S. 79–87, doi:10.1016/S0165-0173(02)00234-5.
- ↑ Kupfer, Mangan, Chrom, Molybdän. Abgerufen am 17. Februar 2023.
- ↑ Cem Ekmekcioglu, Wolfgang Marktl: Essentielle Spurenelemente: Klinik und Ernährungsmedizin. Springer, 2006, ISBN 3-211-20859-3, S. 148 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Annette Santamaria, Sandra Sulsky: Risk Assessment of an Essential Element: Manganese. In: Journal of Toxicology and Environmental Health, Part A. 73, 2010, S. 128–155, doi:10.1080/15287390903337118.
- ↑ David N. Caplan, Otto Rapalino, Amel Karaa, Rachel P. Rosovsky et al.: Case 35-2020: A 59-Year-Old Woman with Type 1 Diabetes Mellitus and Obtundation, New England Journal of Medicine 2020, Band 383, Ausgabe 20 vom 12. November 2020, Seiten 1974–1983, DOI: 10.1056/NEJMcpc2002412
- ↑ Merkblatt zur BK Nr. 1105 Bek. des BMA v. 19. Mai 1964, BArbBl Fachteil Arbeitsschutz 1964, 128f.
- ↑ Jared A. Jaffey, Tamara Chamberlin, Jennifer J. Hu: Acute manganese toxicosis related to joint health supplement ingestion in two dogs. In: Topics in companion animal medicine. 2024, Band 61, S. 100877 doi:10.1016/j.tcam.2024.100877.
- ↑ J. Strähle, E. Schweda: Jander · Blasius – Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. Hirzel Verlag, Stuttgart 1995, ISBN 3-7776-0672-3, S. 186–192.
- ↑ J. Strähle, E. Schweda: Jander · Blasius – Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. Hirzel Verlag, Stuttgart 1995, ISBN 3-7776-0672-3, S. 460.
- ↑ J. Strähle, E. Schweda: Jander · Blasius – Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. Hirzel Verlag, Stuttgart 1995, ISBN 3-7776-0672-3, S. 378–379.
- ↑ O.G. Koch: Analytische Chemie des Mangans. Springer-Verlag, 2013, ISBN 978-3-642-69853-8, S. 95ff.
- ↑ Bernt Krebs, Klaus-Dieter Hasse: Hexamanganato(VII)-mangan(IV)-säure: eine „Pseudopermangansäure“. In: Angewandte Chemie. Band 86, Nr. 17, 1974, S. 647–648, doi:10.1002/ange.19740861708.
- ↑ Heinrich Remy: Lehrbuch der Anorganischen Chemie. Band II, Akademische Verlagsgesellschaft Geest & Portig, Leipzig 1961, S. 255–258.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 978-3-11-022566-2, S. 831 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Arno H. Reidies: Manganese Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005 (doi:10.1002/14356007.a16_123).
- ↑ M. F. Bellin: MR contrast agents, the old and the new. In: European Journal of Radiology Band 60, Nummer 3, Dezember 2006, S. 314–323, doi:10.1016/j.ejrad.2006.06.021. PMID 17005349.
- ↑ Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 460–468.










