Fischer-Tropsch-Synthese


Die Fischer-Tropsch-Synthese (auch Fischer-Tropsch-Verfahren, kurz FT-Synthese) ist ein großtechnisches, heterogenkatalytisches Polymerisationsverfahren zur Herstellung von Kohlenwasserstoffen. Dabei wird an cobalt- oder eisenhaltigen Katalysatoroberflächen adsorbiertes Kohlenstoffmonoxid mit Wasserstoff hydriert. Die Reaktionen finden bei Temperaturen von etwa 150 bis 350 °C und Drücken von 1 bis etwa 25 bar statt. Das Verfahren umfasst die Erzeugung von Synthesegas, dessen Umsetzung zu Fischer-Tropsch-Produkten und deren Weiterverarbeitung. Für die Erzeugung des Synthesegases stehen Kohle, Erdgas, Biomasse oder organischer Abfall als Rohstoffquellen zur Verfügung. Aufgrund der Vielzahl möglicher Einsatzstoffe nimmt die Fischer-Tropsch-Synthese eine zentrale Stellung bei der Suche nach Alternativen zum Erdöl zur Gewinnung flüssiger Kohlenwasserstoffe ein.
Die Produkte der Fischer-Tropsch-Synthese sind synthetische Motoröle sowie flüssige synthetische Kraftstoffe wie Otto- und Dieselkraftstoff, die praktisch frei von Schwefel- und Stickstoffverbindungen sind und geringere Abgasemissionen als herkömmlicher Dieselkraftstoff aufweisen. Anfallende längerkettige Kohlenwasserstoffe dienen als Rohstoffbasis für die chemische Industrie oder als Fischer-Tropsch-Wachs als Hilfsmittel in der Klebstoffindustrie, für Beschichtungen oder in der Polymerverarbeitung. Durch die Wahl geeigneter Prozessparameter lässt sich die Produktpalette in Richtung höherer Olefine, die als Chemierohstoffe verwendet werden, verschieben. Koppelprodukte des Prozesses sind Wasser und Kohlenstoffdioxid. Als Nebenprodukte fallen sauerstoffhaltige Kohlenwasserstoffe wie Ethanol und Aceton sowie höhere Alkohole an.
Die deutschen Chemiker Franz Fischer und Hans Tropsch entwickelten das Verfahren am Kaiser-Wilhelm-Institut für Kohlenforschung in Mülheim an der Ruhr und meldeten es 1925 zum Patent an. Im Zuge der nationalsozialistischen Autarkiepolitik erlangte die Fischer-Tropsch-Synthese in Deutschland eine hohe wirtschaftliche Bedeutung, da sie zur Deckung des Bedarfs an flüssigen Kraft- und Schmierstoffen sowie zur Bereitstellung von Chemierohstoffen auf Basis heimischer Kohle beitrug.
In Südafrika errichtete die Firma Sasol ab Mitte der 1950er Jahre große Fischer-Tropsch-Anlagen, die Synthesegas aus südafrikanischer Kohle zu Benzin und Grundstoffen für die chemische Industrie weiterverarbeiten. In China, Russland, Malaysia und Katar liefern moderne Fischer-Tropsch-Anlagen im 21. Jahrhundert flüssige Kraftstoffe aus Kohle und Erdgas. Konzepte zur Umwandlung von regenerativ erzeugtem Wasserstoff und Kohlenstoffdioxid in flüssige Kraftstoffe mittels Fischer-Tropsch-Synthese im sogenannten Power-to-Liquid-Verfahren befinden sich derzeit im Forschungsstadium. Die Herstellung flüssiger Kraftstoffe mit hoher Energiedichte auf Basis erneuerbarer Energien gewinnt als Speicheroption sowie als Technologie zur Kohlenstoffabscheidung und -nutzung zunehmend an Interesse.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Arbeiten am Kaiser-Wilhelm-Institut für Kohlenforschung
[Bearbeiten | Quelltext bearbeiten]
Der Mangel an Erdöl und die damit verbundenen Engpässe in der Treibstoffversorgung während des Ersten Weltkriegs führten im Deutschen Reich in der Zeit nach dem Krieg zu einer politisch und militärisch motivierten Suche nach Alternativen, vor allem auf der Basis der heimischen Kohle. Franz Fischer, Gründungsdirektor des 1912 errichteten Kaiser-Wilhelm-Institut für Kohlenforschung in Mülheim an der Ruhr, dessen Unterhalt zum großen Teil von der Kohleindustrie finanziert wurde, setzte seinen Forschungsschwerpunkt zu Beginn der 1920er Jahre auf die Verwertung von Kokereigas. Dabei handelt es sich um ein Gemisch aus Wasserstoff, Methan, Stickstoff und Kohlenstoffmonoxid, das bei der Verkokung der Kohle anfiel und der Schwerindustrie im Überschuss zur Verfügung stand. Zusammen mit Hans Tropsch entwickelte er 1921 ein auf alkalisierten eisenhaltigen Katalysatoren basierendes Verfahren zur Herstellung von Gemischen aus sauerstoffhaltigen Verbindungen aus Synthesegas, das sogenannte Synthol-Verfahren.[1] Bei einem Druck von 100 bis 150 bar und einer Temperatur von etwa 400 °C erhielten sie Mischungen von Aldehyden, Ketonen, Carbonsäureestern, Alkoholen und Carbonsäuren, sogenanntes Synthol.
Fischer beauftragte Otto Roelen, der als Assistent von Tropsch bereits seit 1921 dem Mülheimer Institut angehörte, ab 1924 zunächst mit der weiteren Untersuchung des Syntholverfahrens. Nachdem sich die damit hergestellten sauerstoffhaltigen Gemische als untauglich für die Verwendung als Motorkraftstoff erwiesen hatten, änderte Tropsch die Reaktionsbedingungen und führte die Versuche unter Normaldruck durch. Obwohl zu Beginn nur geringe Ausbeuten erzielt wurden, führten die Arbeiten von Fischer, Tropsch und Roelen schließlich zur technischen Herstellung von aliphatischen Kohlenwasserstoffen unter Verwendung von Cobalt- oder Eisenkatalysatoren.[2]
Franz Fischer und Helmut Pichler entwickelten 1936 die Mitteldrucksynthese mit Hilfe von Eisenkatalysatoren. Bei erhöhtem Betriebsdruck lieferten alkalisierte Eisenkatalysatoren gute Umsätze bei der Fischer-Tropsch-Synthese, die Standzeiten der Katalysatoren verlängerten sich signifikant. Die Eisenkatalysatoren waren zudem preiswerter, beständiger gegenüber Veränderungen der Prozessvariablen und ermöglichten so die Herstellung eines breiteren Spektrums an Reaktionsprodukten.[3] Die Verwendung von Ruthenium als Katalysator bei einem Druck über 30 Bar zur Herstellung von hochschmelzenden Paraffinen wurde ebenfalls untersucht, jedoch industriell nicht weiter verfolgt.[4]
Großtechnisches Verfahren
[Bearbeiten | Quelltext bearbeiten]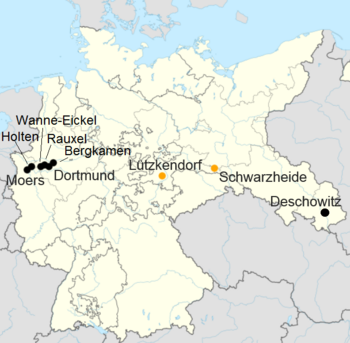
 Braunkohle,
Braunkohle,  Steinkohle.
Steinkohle.Die Ruhrchemie erwarb die Rechte an dem Verfahren. Sie errichtete die erste industrielle Fischer-Tropsch-Anlage 1934 am Standort Holten.[5] Während des Zweiten Weltkriegs erlangte die Fischer-Tropsch-Synthese kriegswirtschaftliche Bedeutung in Deutschland. Mit ihr konnte unter anderem ein Teil des Bedarfs an flüssigen Kraftstoffen und Kogasin gedeckt werden.[6] Insgesamt errichtete die Industrie bis zum Ende des Zweiten Weltkrieges neun Anlagen nach dem Fischer-Tropsch-Verfahren mit einer Kapazität von rund 600.000 Jahrestonnen. Im Jahr 1942 betrug die Produktionsmenge in Deutschland für das Niederdruckverfahren 427.400 Tonnen und für das Mitteldruckverfahren 128.800 Tonnen.[7]
In Frankreich betrieb der französische Chemiekonzern Société de Produits Chimiques Courrieres-Kuhlmann ab 1937 zwei Fischer-Tropsch-Anlagen: eine Pilotanlage in L’Estaque (Marseille) und eine Anlage mit einem Durchsatz von 11.000 Tonnen pro Jahr in Harnes. Letztgenannte arbeitete mit Cobalt-Katalysatoren.[8][9]
Mitte 1936 gründeten Forschungsleiter der Kaiserlichen Universität Tokio in Kooperation mit dem Zaibatsu Mitsui Bussan K.K. das Kaiserliche Forschungsinstitut für Treibstoffe mit Sitz in Kyoto, das zeitgleich von der Ruhrchemie AG eine Lizenz für den Bau von Fischer-Tropsch-Anlagen in Japan erwarb. Im November 1936 begann die Errichtung der ersten drei Werke in Amagasaki mit 30.000, Omuta mit ebenfalls 30.000 und Takikawa mit 50.000 Jato. Die Anlagen gingen alle Ende 1939/Anfang 1940 mit dem jeweils geplanten Durchsatz in Betrieb. Produziert wurde hauptsächlich Schiffsdiesel. Zwei weitere japanische Fischer-Tropsch-Anlagen entstanden in Mandschukuo, wovon jedoch nur eine kurz vor Kriegsende mit einer Kapazität 40.000 Kubikmeter fertiggestellt werden konnte.[10][11][12]
Auch die Regierung der Vereinigten Staaten erkannte den strategischen Wert der Fischer-Tropsch-Synthese für die Herstellung flüssiger Kraftstoffe auf Basis von Kohle oder Ölschiefer. Bereits vor dem Zweiten Weltkrieg wurde die Fischer-Tropsch-Forschung finanziert. Die Förderung wurde durch den „Synthetic Liquids Fuels Act“ erheblich erweitert, für den der US-Kongress 30 Millionen US-Dollar (2024: etwa 462.000.000 US-Dollar) über einen Zeitraum von fünf Jahren bewilligte.[13]
| Standort | Betreiber | Anteilseigner | Inbetriebnahme | Prozess 1 | Einsatzstoff | Produktionskapazität 1943/44 in Tonnen pro Jahr |
|---|---|---|---|---|---|---|
| Holten | Ruhrchemie AG | Ruhrchemie AG (100%) | 1936 | ND / MD | Steinkohle | 60.000 |
| Rauxel | Gewerkschaft Victor | Klöckner-Werke AG (52%) / Wintershall AG (48%) | 1937 | ND | Steinkohle | 40.000 |
| Wanne-Eickel | Krupp Treibstoffwerk GmbH | Friedrich Krupp AG (100%) | 1938 | ND / MD | Steinkohle | 55.000 |
| Bergkamen | Chemische Werke Essener Steinkohle AG | Friedrich Flick (100%) | 1939 | ND | Steinkohle | 85.000 |
| Dortmund | Hoesch-Benzin GmbH | Hoesch AG (100%) | 1939 | MD | Steinkohle | 55.000 |
| Moers | Steinkohlenbergwerk Rheinpreußen Treibstoffwerk | Franz Haniel & Cie. (100%) | 1936 | ND | Steinkohle | 75.000 |
| Schwarzheide | Brabag | Brabag | 1936 | ND | Braunkohle | 180.000 |
| Lützkendorf | Wintershall A.G. Werk Lützkendorf | Wintershall AG (100%) | 1938 | ND | Braunkohle | 30.000 |
| Deschowitz | Schaffgotsch-Benzin GmbH | Familie Schaffgotsch (52%) / Familie Ballestrem (48%) | 1939 | MD | Steinkohle | 40.000 |
| Summe aller FT-Anlagen | 620.000 | |||||
Anfang 1944 lieferte die Kohleindustrie in Deutschland etwa zwei Drittel des benötigten Treibstoffs. Die Fischer-Tropsch-Synthese hatte daran einen Anteil von 7 %, während das Bergius-Pier-Verfahren etwa 40 % lieferte. Quellen wie die Destillation von Steinkohlenteer und die Benzolgewinnung trugen zusammen 17 % bei.[7] Da die Fischer-Tropsch-Kraftstoffe eine niedrige Oktanzahl aufwiesen, baute die nationalsozialistische Wirtschaftsführung stattdessen mehr Hydrieranlagen nach dem Bergius-Pier-Verfahren, die ein höherwertiges Benzin lieferten.[5]
Ein Verfahren von Arthur Imhausen nutzte die höhermolekulare Fraktion der Fischer-Tropsch-Synthese, das Paraffingatsch, zur Fettsäuresynthese durch Paraffinoxidation.[15] Die Fettsäuren wurden von der Märkische Seifenindustrie als Rohstoff genutzt und ab 1939 zur Herstellung eines synthetischen Speisefetts verwendet.[16] Ab 1940 steigerten die Fischer-Tropsch-Anlagen ihre Produktion erheblich, was zu einer guten Versorgung mit Paraffingatsch führte. Auf Veranlassung von Imhausen veranlasste Wirtschaftskommissar Wilhelm Keppler die Umstellung der Fischer-Tropsch-Anlagen auf das Mitteldruckverfahren, das eine höhere Ausbeute an Paraffingatsch lieferte.
Nachkriegszeit
[Bearbeiten | Quelltext bearbeiten]

Infolge der alliierten Öl-Offensive waren nach dem Zweiten Weltkrieg die Anlagen der deutschen Treibstoffindustrie erheblich, meist total zerstört. In Westdeutschland untersagten die Westalliierten eine baldige Instandsetzung und Wiederinbetriebnahme, zunächst durch direkte von der britischen Besatzung erlassene Verbotsbestimmungen für einen Wiederaufbau industrieller Anlagen. Später wurde durch die Bestimmungen des Washingtoner Abkommens vom 6./8. April 1949, die die direkte oder indirekte Hydrierung von Benzin, Öl und Schmieröl aus Steinkohlen oder Braunkohlen durch das Bergius-Pier-Verfahren, die Fischer-Tropsch-Synthese oder analoge Verfahren verboten. Fortan deckten britische und US-amerikanische Ölkonzerne nahezu den kompletten Mineralölbedarf in den westlichen Besatzungszonen.[17][18][16][19]
Das Produktionsverbot wirkte sich nicht nur auf die Kraftstoffproduktion, sondern auf die gesamte westdeutsche chemische Industrie aus. Die sechs im Ruhrgebiet vorhandenen Fischer-Tropsch-Werke waren bei der Erzeugung von Ausgangsprodukten für Kunststoffe, Schmiermittel, Fettsäuren, Waschmittel, Arzneimittel etc. von erstrangiger Bedeutung für den wirtschaftlichen Wiederaufbau.[20] Dementsprechend stießen die Demontagebefehle auf heftigen Widerstand: Unternehmer, Arbeitnehmer, Behörden, die Landes- und spätere Bundesregierung legten Widerspruch bei der Alliierten Hohen Kommission der westlichen Siegermächte ein und wiesen auf den Verlust von Arbeitsplätzen und die Bedeutung der Werke für die deutsche Wirtschaft insgesamt hin. Mit dem Petersberger Abkommen erreichte Konrad Adenauer einen Demontagestopp, das Produktionsverbot wurde 1951 aufgehoben.[17]
Zu diesem Zeitpunkt hatte das anglo-amerikanische Erdöl den westdeutschen Mineralölmarkt jedoch schon soweit erobert, dass sich nur wenige Unternehmen entschlossen, ihre carbochemischen Werke wiederaufzubauen und in Betrieb zu nehmen. Vielmehr waren zu dieser Zeit die meisten Anlagen bereits auf die Veredlung von Erdöl umgestellt worden. Eine Rolle spielte dabei auch der Marshallplan, der generell keine Förderung des Kohlebergbaus beinhaltete.[21][22] Mit der Aufhebung der Steuerbefreiung für inländische Mineralöle von 1960 setzte in der Bundesrepublik jener Verdrängungsprozess durch Erdöl und Erdgas ein, dem bis auf die Kokereien alle thermisch-chemischen Kohleveredlungsanlagen zum Opfer fielen.[23]
In der sowjetischen Besatzungszone wurden – wie im Westen Deutschlands – zunächst das deutsche Know-how ausspioniert, ganze Anlagenteile der Hydrier- und Fischer-Tropsch-Werke demontiert und als Beutegut in die Sowjetunion verbracht. Die DDR führte die im Dritten Reich praktizierte Autarkiepolitik fort und unternahm große Anstrengungen, trotz umfangreicher Zerstörung und zu leistender Reparationslieferungen die Produktion möglichst schnell wieder aufzunehmen.[24] In der Niederlausitz befand sich das größte Fischer-Tropsch-Werk (Brabag Schwarzheide) mit hochmodernen Laboren.[25] Bereits ab Juni 1945 erfolgte hier die Produktion von Treibstoffen für die Sowjetunion. Bis Ende 1952 musste die Werksleitung umfangreiche Dokumentationen über „Verfahren und Vorrichtungen zum Waschen von Gasen und Flüssigkeiten“ anfertigen. Schließlich erfolgte unter dem neuen Namen VEB Synthesewerk Schwarzheide eine Reihe von Patentanmeldungen, die alle auf den Brabag-Patenten von vor 1945 beruhten.[26]
In den Anlagen erfolgte die Vergasung von Braunkohle nach dem Koppers-Wälzgasverfahren und die Herstellung von Kohlenwasserstofferzeugnissen aus dem Synthesegas unter Normaldruck mit Cobalt-Katalysatoren. 1965 betrug die Produktionsleistung in Schwarzheide 150.000 Jahrestonnen.[27] Zur Oktanzahlverbesserung bei der Benzinherstellung stand den Hydrier- und Synthesewerken in der DDR Tetraethylblei aus Premnitz zur Verfügung.[28] Im VEB Kombinat Synthesewerk, Schwarzheide waren zu dieser Zeit rund 12.000 Arbeitskräfte beschäftigt.[29] Nach Aufnahme einer Herbizidproduktion und der Errichtung eines Komplexes zur Polyurethanherstellung wurden die Fischer-Tropsch-Anlagen in Schwarzheide Ende 1972 außer Betrieb genommen. Das Werk schied zu diesem Zeitpunkt aus der Mineralölwirtschaftsbranche aus.[28] Dennoch entwickelte die DDR mit ihren reichen Braunkohlevorkommen und Erdölmangel sowohl das Bergius-Pier- als auch das Fischer-Tropsch-Verfahren weiter und betrieb ein Kompetenzzentrum für Kohleverflüssigung in Freiberg, das Deutsche Brennstoffinstitut.[30]
Als der Zweite Weltkrieg am 15. August 1945 auch im pazifischen Raum endete, hatte Japan insgesamt 15 Anlagen zur Kohleverflüssigung, davon vier im Fischer-Tropsch-Verfahren fertiggestellt. Alle Werke zusammen erzielten 1944 eine Spitzenproduktion von 114.000 Kubikmeter synthetischer Treibstoffe. Wenige Tage vor der Kapitulation Japans flog die United States Army Air Forces Angriffe auf die japanischen Hydrier- und Synthesewerke. Die Anlagen waren danach größtenteils zerstört und mussten den Betrieb einstellen.[31] Eine Wiederinbetriebnahme wurde Japan analog der alliierten Vorgehensweise in Westdeutschland untersagt. Nach Aufhebung der Verbote musste die japanische Wirtschaft ihre chemische Industrie ebenfalls hauptsächlich auf anglo-amerikanisches Erdöl umstellen, zumal für sie der Zugang zu den riesigen und sehr einfach zu gewinnenden Kohle- und Schieferölvorkommen in der Mandschurei und Korea weggefallen war. Die dortigen japanischen Treibstoffwerke gingen im Zuge der sowjetischen Invasion der Mandschurei und Nordkorea als Kriegsbeute nach Sibirien, wo ab Juni 1945 eine komplett neue Industriestadt für rund 250.000 Menschen entstand: Angarsk – die „Stadt des Sieges“, auch „Stadt des Öls“ genannt. Der Standort mit immensen Kohlevorkommen an einer Nehrung der Angara wurde für den Bau verschiedener Anlagen zur Herstellung synthetischer Flüssigbrennstoffe gewählt, deren überwiegende Ausrüstung von Reparationsleistungen aus Deutschland stammte. Die Errichtung der geschlossenen Stadt dauerte zehn Jahre und erfolgte durch Häftlinge des speziell eingerichteten Gulag KitoiLag.[32][33]
1952 gingen die ersten Anlagen in Angarsk als Katalysatorenfabrik Kombinat 16 in Betrieb. Insgesamt gab es in der Sowjetunion drei Orte, an die alle konfiszierten deutschen und japanischen Ausrüstungen zur Kohleverflüssigung verlegt wurden: Angarsk, Nowotscherkassk und Salawat.[34] Auch mehrere demontierte Anlagenteile von Fischer-Tropsch-Werken aus dem Ruhrgebiet kamen als Reparationsleistung in die Sowjetunion. Das größte deutsche Synthesewerk, das komplett demontiert in die Sowjetunion gelangte, waren die schlesischen Schaffgotsch-Benzin-Anlagen.[35] An der Staatlichen Universität Irkutsk existierte ein Institut für Petrochemie und Kohle-Chemie-Synthese, dessen Wissenschaftler ab 1991 gemeinsam mit den Chemikern des Werkes in Angarsk am Einsatz neuer Fischer-Tropsch-Synthesekatalysatoren unter anderem mit Ruthenium und Wolframcarbid forschten.[36] 2014 vermeldete der Betreiber, dass das Werk in Angarsk das erste russische Unternehmen sei, das in der Lage ist, Fischer-Tropsch-Katalysatoren im kommerziellen Maßstab herzustellen.[37]
Eine weitere russische Fischer-Tropsch-Anlage befindet sich seit 1952 in Nowokuibyschewsk. Anfangs erzeugte das Werk das benötigte Synthesegas durch Vergasung von Anthrazitkohle, ab Beginn der 1980er Jahre erfolgte die Umwandlung von Erdgas. Zu dieser Zeit betrug die Kapazität der Anlage 50.000 Tonnen pro Jahr.[38] Im Jahr 2006 produzierte das Werk unter anderem Ethylen, Synthesekautschuk und diverse Kunststoffe.[39] Im Jahr 2016 wurden laut Betreiber 1,2 Millionen Tonnen Kohlenwasserstoff-Rohstoffe verarbeitet. Zu den weiteren Primärprodukten zählen Phenol, Aceton, α-Methylstyrol und Olefine.[40] Die beiden Werke in Angarsk und Nowokuibyschewsk werden gegenwärtig von Rosneft betrieben. Das Angarsker Werk für Katalysatoren und organische Synthese feierte im Jahr 2022 seine 70-jährige Produktionstätigkeit. Hergestellt wird dort unter anderem der synthetische Dieselkraftstoff Baikat.[41][42]
In Frankreich hatte die I.G. Farben im Jahr 1941 die Aktienmehrheit der Société de Produits Chimiques Courrieres-Kuhlmann übernommen. Die Fischer-Tropsch-Anlage in Harnes wurde bereits ab 1942 von alliierten Luftstreitkräften angegriffen, sodass die Produktion wegen der Bombenschäden wiederholt zum Erliegen kam. Das Werk ging nach dem Ende des Zweiten Weltkriegs nicht wieder in Betrieb.[43] Aufgrund seiner Kollaboration stellte die französische Regierung den Kuhlmann-Konzern unter Sequester. Es folgte eine lange Zeit des Stillstands, bevor die Familie Kuhlmann ihr Eigentum 1951 zurückerhielt. Das Unternehmen arbeitete später unter anderem eng mit der BASF zusammen und führte erneute Lizenzverhandlungen mit der Ruhrchemie über den Bau moderner Fischer-Tropsch-Anlagen.[44][43][25]
Neben dem Bruceton Research Center in der Nähe von Pittsburgh (Pennsylvania) betrieb die US-Regierung (U.S. Bureau of Mines) von 1949 bis 1953 zwei kleine Versuchsanlagen zur Herstellung von synthetischem Benzin in Louisiana (Missouri), darunter eine Fischer-Tropsch-Anlage mit einem Durchsatz von 50 Barrel pro Tag. Darüber hinaus errichteten US-amerikanische Energieunternehmen Ende der 1940er bis Mitte der 1950er Jahre Fischer-Tropsch-Großanlagen in Garden City (Kansas), Brownsville (Texas) und Liberty (Pennsylvania). Keines der drei privat betriebenen Werke erreichte die geplanten Kapazitäten, weshalb sie alle aus wirtschaftlichen und technischen Gründen bereits gegen Ende der 1950er Jahre abgeschaltet wurden.[45] Beispielsweise betrieb die Carthage Hydrocol Company die Anlage in Brownsville im zu diesem Zeitpunkt noch nicht ausgereiften Hydrocol-Verfahren, sodass sich das Unternehmen entschloss, kein weiteres Kapital in das Projekt zu investieren.[46]
Verfahren der Sasol
[Bearbeiten | Quelltext bearbeiten]


In der Republik Südafrika, die über ausreichend leicht abbaubare Kohleressourcen verfügt und Erdöl importieren muss, erwarb im Jahr 1935 die Anglo-Transvaal Consolidated Investment Company Limited (Anglovaal) von der Ruhrchemie eine Lizenz zum Bau von Fischer-Tropsch-Anlagen.[47] Sinkende Ölpreise und das Herannahen des Zweiten Weltkriegs beendeten die Umsetzung der südafrikanischen Autarkiepläne vorübergehend. Am 25. Mai 1950 übertrug Anglovaal die Lizenzrechte an die Regierung, die umgehend mit dem Bau eines Werks nebst der neuen Industriestadt Sasolburg begann. Die Anlage ging 1954 in Betrieb.[48]
Errichtet wurde die erste südafrikanische CtL-Anlage (Coal-to-Liquid) durch das eigens gegründete staatliche Unternehmen Suid Afrikaanse Steenkool en Olie (Sasol). Der Aufbau des Werks erfolgte unter Beteiligung der deutschen Lurgi AG. Die Pilotanlage Sasol 1 war für etwa 6.000 Barrel Kraftstoff pro Tag ausgelegt, ein Teil der Anlage produzierte Wachse und andere synthetische Produkte.[49] Infolge der weltweiten Ölkrise 1973 ließ die südafrikanische Regierung ab dem Jahr 1974 den Produktionsstandort Secunda bauen. Südafrika erweiterte die Kapazitäten bedingt durch die Apartheid und die damit verbundenen europäischen und US-amerikanischen Sanktionen deutlich. Mit Sasol II und Sasol III gingen 1980 und 1982 die größten Kohleverflüssigungsanlagen der Welt in Betrieb, die über eine Gesamtkapazität von 104.000 Barrel/Tag verfügten.[15]
Die Anlagen wurden nach dem Ende der Apartheid stetig erweitert. In Mossel Bay ging 1992 ein weiteres von der Regierung finanziertes Fischer-Tropsch-Werk in Betrieb, in dem off-shore gewonnenes Erdgas verarbeitet wird.[49] 2006 produzierte Südafrika etwa 40 % seines Kraftstoffbedarfs aus Kohlebenzin.[50] Im Jahr 2020 lieferten allein die Anlagen in Secunda jährlich 8,8 Millionen Tonnen flüssige Kraftstoffe.[51] Typische Produkte sind Motorenbenzin und Diesel.
Sasol entwickelte sich zum Weltmarktführer auf dem Gebiet der XtL-Technologien und baute unter anderem 2006 in Katar ein modernes GtL-Werk mit einer Kapazität von 34.000 Barrel/Tag. Dabei handelt es sich um ein Hochtemperaturverfahren mit Prozesstemperaturen von 350 °C (Synthol und Advanced Synthol), bei dem Ottokraftstoffe und Alkene als Plattformchemikalien produziert werden. Durch Hydrocracken der entstehenden Wachse wird hauptsächlich Diesel produziert.[49]
Ebenfalls mit Beteiligung von Sasol wurde ab 2013 in Ningdong (Provinz Ningxia, China) eine große CtL-Anlage gebaut.[52] Das von der Shenhua Ningxia Coal Industry Group, einer Tochtergesellschaft der Shenhua Group, betriebene Werk ging am 28. Dezember 2016 in Produktion und wandelte zu diesem Zeitpunkt bereits jährlich 20 Millionen Tonnen Kohle in rund 4 Millionen Tonnen Öl um (etwa 100.000 Barrel pro Tag). Mittels eisenbasierter Mitteltemperatur-Fischer-Tropsch-Technologie werden überwiegend Dieselkraftstoff und Wachse produziert.[53]
Weitere Anlagen unter Beteiligung des Sasol entstanden in Malaysia und Nigeria.[54] In der Provinz Qashqadaryo ging im September 2022 Usbekistan GTL (UzGTL) in Betrieb. Das Fischer-Tropsch-Projekt wurde gemeinsam von Sasol, Petronas und Uzbekneftegaz entwickelt. Die Anlage soll aus Erdgas 1,5 Millionen Tonnen pro Jahr synthetische Flüssigkraftstoffe wie Kerosin, Diesel, Naphtha im Gesamtwert von 1 Milliarde US-Dollar produzieren (Stand 2022).[55][56][57] Des Weiteren gab Botswana im Dezember 2022 an, mit Unterstützung von Sasol eine CtL-Anlage mit einer Kapazität von 12.000 Barrel pro Tag zu bauen.[58]
Trotz hoher Investitionskosten und dem Risiko für Investitionsverluste bei fallenden Ölpreisen wuchs das Interesse an der Fischer-Tropsch-Synthese vor allem in kohlereichen Ländern. Die im 21. Jahrhundert begonnenen Projekte und die in Betrieb genommenen Anlagen befinden sich hauptsächlich in Asien, vor allem in China. Dies ist auf die niedrigen Kosten und die großen Kohlevorkommen in diesen Ländern zurückzuführen. Weitere Faktoren für den Bau von Fischer-Tropsch-Synthesewerken sind steigende Ölpreise, der Wunsch nach Energieunabhängigkeit und -sicherheit sowie das Potenzial für die gemeinsame Entwicklung von Technologien zur CO2-Abscheidung und -Speicherung (Carbon Capture and Storage, CCS) zur Reduzierung von Treibhausgasemissionen.[59]
So hat sich Sasol CO2-Reduktionsziele von 15 % bei bestehenden Anlagen bis 2020 und 30 % bei allen neuen CtL-Betrieben bis 2030 gesetzt und arbeitet als Mitglied des südafrikanischen Centre for Carbon Capture and Storage am Aufbau einer emissionsarmen CCS-Demonstrationsanlage. Dabei wird an verbesserten Verfahren gearbeitet, die unter anderem das Prinzip des Chemical looping combustion (CLC) verwenden. Hier dienen Anteile von H2 und CO, die nicht zu Kohlenwasserstoffen umgesetzt werden konnten, zur Herstellung reinen Wasserstoffs, der dem Prozess wieder zugeführt werden kann. Dies würde die Ausbeute um 10 % erhöhen und gleichzeitig die Anwendung von CO2-Abscheidung und -Speicherung erleichtern.[60]
Weitere Entwicklungen
[Bearbeiten | Quelltext bearbeiten]
1993 nahm der Mineralölkonzern Royal Dutch Shell seine erste GtL-Anlage in Betrieb. Die Anlage in Bintulu in Malaysia hat eine Kapazität von 12.000 Barrel/Tag und wird in einem eigens entwickelten Fischer-Tropsch-Verfahren, der Shell Middle Distillate Synthesis (SMDS-Verfahren), betrieben.
Die USA verfügen über große, dicht an der Oberfläche liegende Kohleflöze, die relativ leicht im Tagebau abgebaut werden können. Die United States Air Force testete angesichts gestiegener Treibstoffpreise bei gleichzeitig hohem Bedarf am 19. September 2006 auf der Edwards Air Force Base eine Boeing B-52H mit einem 50:50-Gemisch aus gewöhnlichem JP-8-Treibstoff und synthetisch aus Kohle gewonnenem Treibstoff.[61] Der Testflug sollte die Frage klären, wie sich dieser Treibstoff in der Praxis bewährt und ob ein wirtschaftlicher Betrieb zuverlässig möglich ist. Ein begleitendes Forschungsprojekt kam zu dem Schluss, dass Fischer-Tropsch-Kraftstoffe eine Alternative als Quelle von JP-8 für die US Air Force bietet.[62] 2009 erfolgte die allgemeine Zulassung der Fischer-Tropsch-Kraftstoffe (FT-SPK) durch die ASTM als Flugkraftstoff. Im Jahre 2014 bevorzugten Fluggesellschaften, wie British Airways und Cathay Pacific die Herstellung von FT-Kraftstoffen aus Hausmüll und hatten mit dem Aufbau entsprechender Anlagen in London und Hongkong begonnen.[63]
Zwar werden Biomass to Liquid-Kraftstoffe in Europa als Biokraftstoffe der zweiten Generation gefördert, jedoch wurde noch keine kommerzielle BtL-Produktion dauerhaft in Betrieb genommen. Die mittlerweile insolventen Choren Industries stellten in einem Werk in Freiberg, Sachsen, den von ihnen als SunFuel und SunDiesel bezeichneten BtL-Kraftstoff her.[64] Die weltweite Kapazität zur Verflüssigung von Kohle und Kohlenwasserstoffen lag 2014 bei etwa 400.000 Barrel pro Tag, was nur einen Bruchteil des weltweiten Bedarfs von etwa 85 Millionen Barrel pro Tag an flüssigen Kraftstoffen ausmacht.[65]
Mögliche extraterrestrische Reaktionen
[Bearbeiten | Quelltext bearbeiten]Die Bildung von Aminosäuren, einer Klasse organischer Verbindungen, die möglicherweise für die Entstehung des Lebens wichtig sind, wurde experimentell durch Fischer-Tropsch-Synthese in Gegenwart von Ammoniak in der Gasphase bei 200 bis 500 °C in Gegenwart von Nickel-Eisen nachgewiesen. Die in Meteoriten gefundenen komplexeren Aminosäuren könnten möglicherweise durch die Fischer-Tropsch-Synthese entstanden sein.[66] Die Fischer-Tropsch-Synthese ist ein möglicher Weg zur Umwandlung von Kohlenstoffmonoxid an Eisenverbindungen in andere Verbindungen im interstellaren und planetaren Medium. Durch den Prozess könnte Kohlenstoffmonoxid, die vorherrschende Kohlenstoffkomponente in interstellaren Nebeln zu Methan reagieren, der dort thermodynamisch bevorzugten Form von Kohlenstoff.[67]
Rohstoffe
[Bearbeiten | Quelltext bearbeiten]
Für Verfahren zur Herstellung von synthetischen Kraftstoffen durch Hydrierung von Kohlenstoffmonoxid mittels Fischer-Tropsch-Synthese wird teilweise die Bezeichnung „XtL“ verwendet, das heißt die Umwandlung jeglicher organischer Rohstoffe in flüssige Kohlenwasserstoffe. Dabei steht „X“ für eine beliebige Rohstoffquelle und „tL“ für das englische „to Liquid“. Gängige Abkürzungen sind „GtL“ für „Gas-to-Liquid“ bei Verwendung von Erdgas, „BtL“ für „Biomass-to-Liquid“ bei Verwendung von Biomasse, „WtL“ für „Waste-to-Liquid“ bei Verwendung von Abfällen und „CtL“ für „Coal-to-Liquid“ bei Verwendung von Kohle als Rohstoff. Die Kombination von Kohle und Biomasse als Rohstoffe im so genannten „CBtL“-Verfahren ist ebenfalls möglich, da die gemeinsame Vergasung eines Gemischs aus Biomasse und Kohle in einem modernen Vergaser durchführbar ist.[69][70] Im „Power-to-Liquid-Verfahren“ (PtL) erfolgt die Umwandlung von Kohlenstoffdioxid mit durch Elektrolyse hergestelltem Wasserstoff zu Synthesegas und anschließender Umsetzung mittels Fischer-Tropsch-Synthese zu flüssigen Kraftstoffen. Dieser Prozess könnte einen Beitrag zur Speicherung von Kohlenstoffdioxid leisten.[71] Zur Unterscheidung von der direkten Kohleverflüssigung nach dem Bergius-Pier-Verfahren („Direct Coal-to-Liquid“, „DCtL“, auch „DCL“) werden Fischer-Tropsch-Verfahren teilweise als indirekte Kohleverflüssigungsverfahren („Indirect Coal-to-Liquid“, „ICtL“, auch „ICL“) bezeichnet.[72] Fischer-Tropsch-Synthesen mit Olefinen als Zielprodukten werden zum Teil als „FTO“, „Fischer-Tropsch-to-Olefins“, bezeichnet.[73]
Synthesegaserzeugung
[Bearbeiten | Quelltext bearbeiten]Die Bereitstellung von gereinigtem Synthesegas ist meist der aufwändigste Teilprozess einer Fischer-Tropsch-Anlage. Beim Einsatz von Kohle erfolgt zunächst die Erzeugung von Wassergas, gefolgt von der Herstellung des zusätzlich benötigten Wasserstoffs. Der letzte Schritt ist die Reinigung des Gases von unerwünschten schwefel- und stickstoffhaltigen Bestandteilen, die wegen der Empfindlichkeit der meisten Katalysatoren gegen diese Stoffe sorgfältig entfernt werden müssen.[9] Vergasungsprozesse werden häufig mit reinem Sauerstoff betrieben, obwohl die Investitions- und Betriebskosten aufgrund der erforderlichen Luftzerlegung höher sind. Die Ausbeute in den Synthesestufen ist jedoch höher, da bei Verwendung von Luft das entstehende Synthesegas durch den Stickstoff stark verdünnt wird und die Folgeprozesse weniger effizient sind.[74]
Auf die Produktion von Synthesegas fallen etwa 60 bis 70 % der Kapital- und Betriebskosten einer Fischer-Tropsch-Synthese auf Kohlebasis. Die Kapitalkosten für die Synthesegaserzeugung aus Erdgas sind um etwa 30 % niedriger. Zudem werden bei der partiellen Oxidation von Methan nur etwa 20 % des Einsatzstoffes zu Kohlenstoffdioxid umgesetzt, bei der Kohlevergasung sind es etwa 50 %.[75]
Kohle
[Bearbeiten | Quelltext bearbeiten]Bei der Kohlevergasung wird Koks oder Braunkohle zunächst bei Temperaturen über 1000 °C, zum Beispiel im Lurgi-Druckvergaser, Winkler-Generator oder Koppers-Totzek-Reaktor, mit Wasserdampf und Luft oder Sauerstoff zu Synthesegas umgesetzt. Die Kohlevergasung verläuft zyklisch. Zunächst wird der glühende Koks durch Einblasen von Luft auf etwa 1000 °C erhitzt, anschließend wird Wasserdampf eingeblasen. Der glühende Koks liefert die benötigte Wärme für die Wassergasreaktion, bei der das Synthesegas entsteht. Der Koks kühlt dadurch ab und muss durch Einblasen von Luft wieder zum Glühen gebracht werden. Ein Zyklus dauert etwa 2 bis 3 Minuten.[9]
Bei zu niedrigen Temperaturen entstehen hauptsächlich Kohlenstoffdioxid und Wasserstoff.
Der Winkler-Generator eignet sich besonders für die Vergasung von Braunkohle, der Lurgi-Druckvergaser wird bei der Synthesegasherstellung für das Fischer-Tropsch-Mitteldruckverfahren eingesetzt.[9] Das entstehende Synthesegas wird danach einer Wasserwäsche unterworfen, die das Gas entstaubt und abkühlt. Bei der Vergasung von Braunkohle im Winkler-Generator erfolgt die Gaserzeugung durch die gleichzeitige Einspeisung von Dampf und Sauerstoff.[9]
- Kohlevergasungsprozesse
-
Lurgi-Druckvergaser
-
Winkler-Wirbelschicht-Vergaser
-
Koppers-Totzek-Flugstromvergaser
Da bei dieser Umsetzung im ersten Schritt nur ein Wasserstoff-zu-Kohlenstoffmonoxid-Verhältnis von 0,7 erreicht wird, wird ein Teil des Kohlenstoffmonoxids mit Wasser in einer Wassergas-Shift-Reaktion zu Kohlenstoffdioxid und Wasserstoff umgesetzt, bis ein Verhältnis von 2:1 erreicht ist.[15] Die Wassergas-Shift-Reaktion wird zum Teil mit speziellen Eisen-Chrom- und Kupfer-Zink-Katalysatoren durchgeführt.[76]
Erdgas
[Bearbeiten | Quelltext bearbeiten]
Für die Nutzung von Erdgas zur Synthesegaserzeugung stehen die Verfahren der partiellen Oxidation und der Dampfreformierung zur Verfügung. Die exotherme, nicht-katalytische partielle Oxidation von Methan zur Synthesegaserzeugung bei der Fischer-Tropsch-Synthese wird mit reinem Sauerstoff nach folgender Formel durchgeführt:[78]
Die partielle Oxidation erfordert eine Brennkammer, die bei Temperaturen zwischen 1200 und 1500 °C betrieben wird. Als Nebenreaktion findet aufgrund der hohen Temperatur die unerwünschte Spaltung von Methan in Kohlenstoff und Wasserstoff statt.
Der entstehende Ruß wird durch eine Gaswäsche entfernt.[78] Eine mögliche Nebenreaktion ist die Bildung von Kohlenstoffmonoxid und Wasserstoff aus Methan und Kohlenstoffdioxid:
Die Dampfreformierung erfolgt mittels eines Nickel-Aluminiumoxid-Katalysators bei etwa 850 bis 940 °C und einem Druck von etwa 3 bar gemäß:
Die Reaktoren der Dampfreformierung sind mit Wärmetauschern zur Wärmerückgewinnung ausgerüstet.
Beim autothermen Reforming handelt es sich um eine Kombination der Dampfreformierung mit der partiellen Oxidation. Die bei der partiellen Oxidation erzeugte Wärme wird dabei für die Dampfreformierung genutzt. Die Gase aus dem Brenner für die partielle Oxidation werden mit Dampf gemischt und in den Dampfreformer geleitet, wodurch der Prozess autotherm wird.[78] Bei der Verwendung von Erdgas als Einsatzstoff für die Fischer-Tropsch-Synthese, bei der ein Synthesegas mit einem Verhältnis von Wasserstoff-zu-Kohlenstoffmonoxid von 2 : 1 erzeugt wird, ist eine Katalysatoraktivität für die Wassergas-Shift-Reaktion nicht erwünscht. Cobaltbasierte Katalysatoren stellen daher die bevorzugte Technologie für GtL-Anlagen dar.[79]
Biomasse und Abfälle
[Bearbeiten | Quelltext bearbeiten]
Ein Vorteil der Fischer-Tropsch-Synthese besteht darin, dass sich verschiedene kohlenstoffhaltige Rohstoffe für die Herstellung von Synthesegas eignen. Neben Kohle und Erdgas bieten sich Biogas, Holz, landwirtschaftliche Abfälle oder Hausmüll für die Herstellung von kohlenstoffdioxidneutralem Diesel an. Verglichen mit Kohle oder Erdgas hat Biomasse jedoch eine geringere Energiedichte. Daher sind die Transportkosten von Biomasse zu einer Fischer-Tropsch-Anlage entsprechend höher.[80]
Bei der Vergasung von Biomasse entsteht ein Synthesegas, das Ammoniak, Schwefelwasserstoff, Chlorwasserstoff und andere Verunreinigungen enthält. Das Synthesegas muss gereinigt und auf das richtige Kohlenstoffmonoxid-Wasserstoff-Verhältnis eingestellt werden. Dieses liegt etwa zwischen 1 : 1 und 1 : 1,5 bei der Vergasung mit Luft und 1 : 1,5 bis 1 : 2,2 bei der Vergasung mit Sauerstoff. Es ist möglich, das Kohlenstoffmonoxid-Wasserstoff-Verhältnis des Synthesegases durch die Wassergas-Shift-Reaktion einzustellen.[81]
Die erzeugten Produkte sind Kraftstoffe und Wachse, die durch Hydrocracken in Diesel umgewandelt werden können. Diese gelten als Biokraftstoffe der 2. Generation. Die weltweit erste Anlage zur Verwertung fester Biomasse wurde 2005 in Choren bei Freiberg gebaut, die jedoch 2011 insolvent wurde. Das Biomassekraftwerk in Güssing enthielt eine Versuchsanlage zur Herstellung eines dieselähnlichen Biokraftstoffs mittels Fischer-Tropsch-Synthese. Auch dieses Kraftwerk ging 2013 in die Insolvenz.[82]
Strom zur Gewinnung von CO2 und H2
[Bearbeiten | Quelltext bearbeiten]Das Fischer-Tropsch-Verfahren eignet sich auch im Rahmen des „Power-to-Liquid“ zur Herstellung von synthetischen Kraftstoffen bzw. E-Fuels.[83] Der Strom wird als Energieträger genutzt, um die anschließenden benötigten Komponenten zu gewinnen. Hierbei wird abgezielt idealerweise CO2 aus der Atmosphäre (Direct-Air-Capture) oder alternativ aus anderen Quellen wie Biomasse oder Punktquellen, wie Kraftwerken, abzutrennen, um diesen für die Herstellung des Synthesegases zu verwenden. Das CO2 muss jedoch zu CO reduziert werden, welches in einer rückwärtigen Wassergas-Shift-Reaktion abläuft:
CO2 + H2→ CO + H2O
Der Wasserstoff stammt bei einem solchen Verfahren aus einer Wasserelektrolyse.[84]
Im nächsten Schritt wird aus CO und H2 das benötigte Synthesegas hergestellt. Ein Vorteil ist die große Reinheit des Produktes, welches in der Fischer-Tropsch-Synthese eingesetzt werden kann. Der Hintergrund ist, dass bei der Abscheidung aus Quellen wie der Atmosphäre oder Punktquellen, wie Kraftwerke, sehr hohe Reinheitsgrade des CO2 erreicht werden können. Beispielsweise kann beim Direct-Air-Capture-Verfahren Reinheitsgrade von bis zu ca. 99,9 % erreicht werden.[85] Bei stationären Einsätzen wie zum Beispiel bei Kraftwerken können Reinheitsgrade von bis zu 99,7 % erreicht werden.[86] Ein erheblicher Kritikpunkt ist der hohe Energiebedarf, der immer wieder Gegenstand von fachlichen Diskussionen ist. Tatsächlich wird für die Abtrennung des CO2, für die Elektrolyse für das H2 und für die Synthesegaserzeugung viel Strom benötigt. Über die Höhe gibt es unterschiedliche Angaben und sie hängen stark von weiteren Rahmenbedingungen wie der angewendeten CO2-Abtrennungstechnolgie und des Elektrolyseurs ab.
Gasreinigung
[Bearbeiten | Quelltext bearbeiten]Die Gasreinigung erfordert mehrere Schritte, um störende Komponenten aus dem Synthesegas zu entfernen. Dazu gehören die Kühlung, wobei Phenol und höhere Kohlenwasserstoffe abgetrennt werden und die Filtrierung, um Staubbestandteile zu entfernen.

Synthesegas enthält weiterhin eine Reihe von Katalysatorgiften und korrosiven Substanzen, die vor dem Einsatz in der Fischer-Tropsch-Synthese entfernt werden müssen. Dazu gehören Schwefelverbindungen wie Carbonylsulfid, Schwefelwasserstoff und Stickstoffverbindungen wie Ammoniak, Cyanwasserstoff und chlorhaltige Verbindungen wie Chlorwasserstoff. Ein Großteil der Schwefelverbindungen wird im ersten Schritt zu Schwefelwasserstoff reduziert.[70] Der Schwefelwasserstoffanteil wird durch die Gasreinigung auf einen Volumengehalt von weniger als 30 ppb herabgesetzt.[15] Die Entfernung von Schwefelwasserstoff aus Synthesegas erfolgt durch die Reaktion mit Rotschlamm, einer Mischung von Eisenoxiden und -hydroxiden wie beispielsweise Eisen(III)-hydroxid und Eisen(III)-oxid. Der Schwefelwasserstoff reagiert gemäß:[9]
In Gegenwart von Luft wird der Rotschlamm zum Teil regeneriert und es scheidet sich reiner Schwefel ab gemäß:
Der feste Schwefel kann gegebenenfalls mittels Kohlenstoffdisulfid aus dem Rotschlamm gelöst werden.[9]
In einer zweiten Feinreinigungsstufe werden organische Schwefelverbindungen entfernt. Dabei wird das Synthesegas bei einer Temperatur von etwa 175 °C über einen Eisenoxid-Natriumcarbonat-Katalysator geleitet.[7]
Chlorwasserstoff, der aus organischen Chlorverbindungen bei der Vergasung erzeugt wird, sowie Ammoniak und Cyanwasserstoff können in einem Wasserwäscher entfernt werden.[70] Eine Reinigung kann ebenfalls mittels einer Rectisolwäsche erfolgen, wobei Kohlenstoffdioxid, Schwefelwasserstoff, Cyanwasserstoff und andere organische Bestandteile entfernt werden.[15]
Katalysatoren
[Bearbeiten | Quelltext bearbeiten]Die Katalysatoren in der industriellen Fischer-Tropsch-Synthese basieren auf Cobalt und Eisen. Andere Übergangsmetalle wie etwa Ruthenium oder Nickel eignen sich ebenfalls für die Hydrierung von Kohlenstoffmonoxid, werden jedoch aus Kosten- oder anderen Gründen wie einer zu hohen Methanisierungsaktivität nicht industriell eingesetzt.[87] Durch die Bildung von flüchtigem Nickeltetracarbonyl kommt es darüber hinaus zu einem Verlust an Katalysatormetall. Als Träger finden poröse Metalloxide mit großen spezifischen Oberflächen wie Kieselgur, Aluminiumoxid, Zeolithe und Titandioxid Verwendung.[88]
Die Gesamtgleichung der Cobalt-katalysierten Fischer-Tropsch-Synthese lässt sich durch die folgende Reaktionsgleichung darstellen:
Für eisenhaltige Katalysatoren gilt die gleiche Gleichung, jedoch wird hier zusätzlich die Wassergas-Shift-Reaktion katalysiert. Dabei entstehen Kohlenstoffdioxid und Wasserstoff:[9]
Die Eisen-katalysierte Gesamtgleichung der Fischer-Tropsch-Synthese lautet:
Aus Kohle oder anderen wasserstoffarmen Rohstoffen hergestelltes Synthesegas wird daher bevorzugt mit eisenbasierten Katalysatoren umgesetzt, da diese gleichzeitig die Wassergas-Shiftreaktion katalysieren und so zur Bereitstellung des zusätzlich benötigten Wasserstoffs beitragen.[90]
Katalysatorherstellung
[Bearbeiten | Quelltext bearbeiten]Die Katalysatoren können durch Imprägnierung poröser Metalloxide mit Metallsalzlösungen und anschließender Kalzinierung hergestellt werden.[91] Die Katalysatoraktivität wird durch Promotoren, dies sind nicht selbst katalytische aktive Katalysatorkomponenten wie Alkalimetalle oder Kupfer, gesteigert. Weiterhin beeinflussen die Porengrößenverteilung des Trägers, die Kalzinierungs- und Reduktionsbedingungen und durch die daraus resultierenden Partikelgrößen des aktiven Katalysatormetalls die katalytische Aktivität. Substanzen wie Alkalimetalle, die für Eisenkatalysatoren gute Promotoren darstellen, wirken etwa bei Cobaltkatalysatoren als Katalysatorgift. Cobalt, Nickel und Ruthenium verbleiben während der Reaktion im metallischen Zustand, während Eisen eine Reihe von Oxiden und Carbiden bildet. Es wird jedoch vermutet, dass Cobaltoxiden, die bei der unvollständigen Reduktion des eingesetzten Salzes zurückbleiben, eine Promotorenrolle zukommt.

- Schritte der Herstellung eisenhaltiger Katalysatoren durch Fällung[92]
Eisen- und cobalthaltige Katalysatoren werden meist durch Fällung, oft zusammen mit anderen Metallen und sonstigen Promotoren, gewonnen.[93][94] Der ursprüngliche Katalysator von Fischer und Tropsch wurde durch Co-Fällung von Cobalt-, Thorium- und Magnesiumnitrat hergestellt, wobei dem frisch gefällten Katalysator das Kieselgur zugesetzt wurde.[95] Die weiteren Schritte wie Formgebung, Trocknung und Reduktion des Cobaltsalzes beeinflussen die Aktivität des Katalysators ebenfalls maßgeblich.
Katalysatordeaktivierung und -regenerierung
[Bearbeiten | Quelltext bearbeiten]Die Standzeiten der frühen Cobaltkatalysatoren des Normaldruckverfahrens wurden mit 3000 Stunden angegeben, wobei eine Regeneration etwa alle 700 Stunden erforderlich war. Während der Deaktivierung wurde die Temperatur von 185 auf 190 °C erhöht, um die nachlassende Aktivität auszugleichen. Pro eingesetzter Tonne Cobalt werden während der Lebensdauer des Katalysators etwa 350 Tonnen Kohlenwasserstoffe gebildet. Die Deaktivierung erfolgte hauptsächlich durch die Ablagerung langkettiger Kohlenwasserstoffe, durch Schwefelvergiftung und durch Sintern. Die abgelagerten Kohlenwasserstoffe konnten zwischen 50 und 100 % des Katalysatorgewichts ausmachen. Sie wurden durch Spülen des Kontaktes mit Dieselkraftstoff bei circa 170 °C gelöst. Dabei wurden bis zu 99 % der Kohlenwasserstoffe entfernt. Anschließend wurde der Katalysator durch eine Wasserstoffbehandlung bei 200 °C reaktiviert.[96]
Die Gesamtlebensdauer der ursprünglichen Cobalt-Thoriumoxid-Magnesiumoxid-Kieselgur-Katalysatoren betrug etwa 4 bis 6 Monate. In dieser Zeit wurde der Kontakt 4- bis 5-mal regeneriert.[96] Anschließend wurde der Kontakt aufgearbeitet und Cobalt und Thorium zurückgewonnen. Für den irreversiblen Verlust der katalytischen Aktivität gibt es verschiedene Ursachen. Neben der Vergiftung des Katalysators durch schwefel- oder stickstoffhaltige Synthesegasbestandteile spielt Abrieb durch mechanische und lokale hydrothermale Beanspruchung durch das entstehende Wasser eine Rolle.[97]
Bei Eisenkatalysatoren wird die Deaktivierung möglicherweise durch Oxidation der katalytisch aktiven Eisencarbid- (FexC) oder metallischen α-Eisenphasen in Magnetit (Fe3O4) verursacht, das bei der Fischer-Tropsch-Synthese inaktiv ist. Eine andere Erklärung liegt in der mechanischen Blockierung der aktiven Zentren durch Graphit- oder Koksablagerungen, die die Adsorption der Reaktanten auf der Oberfläche des Katalysators verhindern. Eine weitere mögliche Ursache ist das Versintern durch thermische Belastung und der damit verbundene Verlust der katalytisch aktiven Oberfläche.[98]
Verfahren
[Bearbeiten | Quelltext bearbeiten]
Die Fischer-Tropsch-Synthese besteht aus mehreren Verfahrensschritten. Der erste Schritt ist die Erzeugung des Synthesegases, die wiederum aus den Schritten der Gaserzeugung, der Erzeugung von zusätzlichem Wasserstoff und der Gasreinigung besteht. Die Verfahrensparameter der eigentlichen Fischer-Tropsch-Synthese richten sich nach der Gaszusammensetzung, der Temperatur, dem Druck, dem verwendeten Katalysator, dem Reaktortyp sowie den Zielprodukten. Entscheidend für die Wahl des Reaktors ist die Abfuhr der erzeugten Reaktionswärme von etwa 3000 Kilojoule pro Kubikmeter umgesetztem Synthesegas.[75] Die Abführung der Wärme wird beispielsweise mit Hilfe von Wasser durchgeführt, dessen Temperatur durch die Einstellung des Drucks regulierbar ist. Bei zu hohen Temperaturen entsteht überwiegend Methan und der Katalysator beginnt zu verkoken.[9]
Die Verfahrensführung unterscheidet sich durch den Temperaturbereich, den Druckbereich, die Reaktoren und die Katalysatoren. Für die Niedertemperatur-Fischer-Tropsch-Synthese, die bei etwa 200 bis 260 °C abläuft, findet sich die Bezeichnung „LTFT“, für „low temperature Fischer-Tropsch“-Technologie, „MTFT“ für „medium temperature Fischer-Tropsch“-Technologie, die im Mitteltemperaturbereich von 270 bis 290 °C arbeitet, und die Hochtemperatur-Fischer-Tropsch-Synthese, die bei 320 bis 350 °C abläuft, wird dementsprechend als „HTFT“-Technologie bezeichnet. Darüber hinaus kann das LTFT-Verfahren sowohl als Normaldruck- als auch als Mitteldruckverfahren durchgeführt werden. Fischer-Tropsch-Synthesen mit Olefinen als Zielprodukten werden zum Teil als „FTO“, „Fischer-Tropsch-to-Olefins“, bezeichnet.[73]
| LTFT | MTFT | HTFT | |
|---|---|---|---|
| Temperatur | 200 bis 260 °C | 270 bis 320 °C | 320 bis 350 °C |
| Katalysator | Fe/Co | Fe | Fe |
| Konventioneller Reaktor | Arge | Synthol | |
| Typ | Rohrreaktor | Kreislaufbett | |
| Moderner Reaktor | Sasol Slurry-Phase Destillate | Synfuels China | Sasol Advanced Synthol |
| Typ | Slurry (Dreiphasen) | Slurry | Wirbelbett |
Als Produkte entstehen eine Reihe von überwiegend geradkettigen Paraffinen mit breiter Kohlenstoffkettenlängenverteilung von Propan über Benzin und Diesel bis zu Paraffingatsch und Hartparaffin. Durch Wahl geeigneter Verfahrensparameter, etwa der Absenkung des Wasserstoffpartialdrucks, lassen sich gezielt Olefine herstellen. Die Trennung der Produkte erfolgt durch verschiedene Verfahren wie Aktivkohleadsorption, Ölwäsche oder Destillation.[9]
Während der Fischer-Tropsch-Synthese reduziert sich das Synthesegasvolumen erheblich, daher wird das Verfahren mehrstufig durchgeführt. In der Anlage der Ruhrchemie etwa reduzierte sich das Synthesegasvolumen in der ersten Stufe von 79,9 Kubikmeter auf 26,1 und in der zweiten Stufe auf 8,9 Kubikmeter. In der ersten Stufe wurden dazu 18 Reaktoren parallel betrieben und in der zweiten Stufe 9 Reaktoren. Nach der zweiten Stufe betrug der Umsatz 96 % bezogen auf Kohlenstoffmonoxid.[101]
Das gereinigte Rohgas, das ein Verhältnis von Wasserstoff zu Kohlenstoffmonoxid von etwa 2 bis 2,2 aufweist, reagiert bereits bei Atmosphärendruck und einer Temperatur von 160 bis 200 °C; technisch werden je nach Verfahren höhere Drücke und Temperaturen verwendet. Die Synthese verläuft nach folgendem Reaktionsschema:
- (Alkane)
- (Alkene)
- (Alkohole)
Pro Kilogramm Kraftstoff entstehen etwa 1,25 Kilogramm Wasser als Nebenprodukt, für dessen Herstellung etwa die Hälfte des eingesetzten Wasserstoffs verbraucht wird.
Verfahrensvarianten
[Bearbeiten | Quelltext bearbeiten]Die Fischer-Tropsch-Synthese ist stark exotherm, unter adiabatischen Bedingungen würde das Synthesegas auf etwa 1500 °C erhitzt.[96] Die entstehende Wärme muss aus dem Reaktor abgeführt werden, da eine unzureichende Wärmeabfuhr zu Schwankungen der Reaktionstemperatur und damit zu erhöhter Methanbildung, geringer Produktselektivität und verkürzter Katalysatorlebensdauer führen kann.
Zur Umwandlung des Synthesegases in Synthesekraftstoffe werden unter anderem Rohr-, Blasensäulen- und Wirbelschichtreaktoren eingesetzt. Für die Fischer-Tropsch-Synthese bei niedrigen Temperaturen werden bevorzugt Festbett- und Wirbelschichtreaktoren eingesetzt.[102]
Ruhrchemie-Normaldruck-Verfahren
[Bearbeiten | Quelltext bearbeiten]
Den ersten industriellen Fischer-Tropsch-Reaktor entwickelte die Ruhrchemie in den 1930er Jahren. Es handelte sich um einen Festbettreaktor, ein sogenannter Kontakt-Ofen, der unter leicht erhöhtem Druck betrieben wurde. Das verwendete Synthesegas bestand zu 28 % aus Kohlenstoffmonoxid, zu 55 % aus Wasserstoff, zu 13 % aus Kohlenstoffdioxid, zu 3,6 % aus Stickstoff und zu 0,5 % aus Methan. Der Synthesegasdurchsatz betrug circa 1000 Kubikmeter pro Stunde, wobei etwa 100 Kilogramm Produkt erzeugt wurden.[96]
Der Katalysator bestand zu 30 % aus Cobalt, zu 2,5 % aus Magnesiumoxid, zu 1,5 % aus Thoriumoxid und zu 66 % aus Kieselgur. Durch die Verwendung von Kieselgur war die Wärmeleitfähigkeit des Kontaktes schlecht. Pro Reaktor wurden drei Tonnen Katalysator eingesetzt, was einer Tonne Cobalt entspricht. Bei einer Schüttdichte von 0,3 Kilogramm pro Liter entsprach dies einem Reaktorvolumen von etwa 10 Kubikmetern. Bei dieser „Normaldruck-Synthese“ befand sich der Katalysator zwischen parallelen Platten, das Kühlwasser floss unter Druck durch Rohre, die senkrecht zu den Platten angeordnet waren. Die Platten dienten zur Wärmeabfuhr. Jeder Reaktor war mit etwa 600 Rohren pro 10 Kubikmeter Katalysatorvolumen ausgestattet. Ein Reaktor war etwa 5 Meter lang, 2,5 Meter hoch und 1,5 Meter breit. Durch die Rohre wurde Wasser unter Druck als Kühlmedium zirkuliert. In einem nachgeschalteten Dampfkessel wurde das Wasser verdampft und so Dampf erzeugt. Pro Kilogramm erzeugtem Produkt fielen dabei fünf Kilogramm Dampf an.[96]
Arge-Synthese
[Bearbeiten | Quelltext bearbeiten]Das Verfahren wird in mehreren Varianten durchgeführt. Neben dem von Fischer und Tropsch entwickelten Normaldruckverfahren wurde das von Pichler entwickelte Mitteldruckverfahren, auch Hochlast- oder Arge-Synthese genannt, von einer Arbeitsgemeinschaft der Firmen Ruhrchemie und Lurgi kommerzialisiert. Dabei erfolgt die Umsetzung der Kohlevergasungsprodukte an mit Kupfer und Kaliumcarbonat dotierten Eisenkontakten im Festbettverfahren bei Temperaturen um 220 bis 240 °C und Drücken bis 25 bar. Das Kohlenstoffmonoxid-zu-Wasserstoff-Verhältnis liegt bei 1 zu 1,7. Das Niedrigtemperatur-Arge-Verfahren produziert überwiegend C12+-Produkte mit einem niedrigen Gehalt an Olefinen.[104]
Die Reaktion ist exotherm mit 158 Kilojoule pro Mol gebildeter CH2-Gruppe bei 250 °C:[15]
Ein Problem ist die Abführung der hohen Hydrierwärme, um eine möglichst isotherme Reaktionsführung zu gewährleisten. Der Arge-Reaktor hatte ursprünglich einen Durchmesser von drei Metern und war mit 2052 Katalysatorrohren bestückt, die etwa 35 Tonnen oder 40 Kubikmeter Katalysator fassen. Der Katalysator ist dabei in engen, von Wasser umspülten Rohren angeordnet. Die freiwerdende Reaktionswärme wird durch Siedewasser unter Druck abgeführt. Eine ungenügende Wärmeabfuhr führt zu einem Temperaturgradienten über der Katalysatorschüttung und kann zu erhöhter Methanproduktion oder einer Verkokung der Kontakte führen.[15] Eine nachlassende katalytische Aktivität der Kontakte wird durch eine Erhöhung der Reaktionstemperatur ausgeglichen.
Das Katalysatorvolumen beträgt in modernen Reaktoren circa 200 Kubikmeter. Eine Fischer-Tropsch-Anlage mit mehreren Reaktoren benötigt pro Stunde etwa 1.500.000 Normkubikmeter Synthesegas und stellt dabei pro Jahr etwa 2.000.000 Tonnen Kohlenwasserstoffe her. Die Synthese wird dreistufig durchgeführt mit einem Gesamtumsatz von circa 94 %.
Rheinpreußen-Koppers-Verfahren
[Bearbeiten | Quelltext bearbeiten]
Neben der Durchführung im Festbettreaktor gibt es weitere Verfahrensvarianten. Bei dem in den 1950er Jahren entwickelten Rheinpreußen-Koppers-Verfahren, zum Teil auch als Kölbel-Rheinpreußen-Verfahren bezeichnet, zum Beispiel erfolgt die Umsetzung des Synthesegases in einem Blasensäulenreaktor, wobei der Katalysator in einer Ölsuspension vorliegt. Die freiwerdende Reaktionswärme führen in die Suspension eingetauchte Kühlrohre ab.[105][106]
Im Festbettverfahren setzt ein Katalysator mit einem Kilogramm Eisen etwa 0,5 Kubikmeter Synthesegas pro Stunde um, während die gleiche Menge Eisen im Rheinpreußen-Koppers-Verfahren etwa die fünf- bis neunfache Menge Synthesegas umsetzt. Dieses wird in Form von kleinen Blasen in den Reaktor eingeleitet. Der Katalysator enthält geringe Mengen Kupfer oder Alkali als Promotoren. Die Umsetzung erfolgt bei einem Druck von etwa 10 Bar und Temperaturen zwischen 200 und 320 °C.[107]
Das Rheinpreußen-Koppers-Verfahren benötigt daher nur eine einstufige Umsetzung. Die benötigte Kühlfläche sinkt von 3000 auf 200 Quadratmeter bei einem Gasdurchsatz von 1000 Kubikmeter pro Stunde, und das Reaktorvolumen beträgt nur etwa 30 % des Festbettverfahrens. Die Kühlflächenkapazität steigt von 960 auf 14.650 Kilojoule und der Umsatz pro Reaktorvolumen vervierfacht sich.[107]
Die Zusammensetzung des Produkts lässt sich in einem weiten Bereich über die Prozesstemperatur steuern. Bei höheren Temperaturen entstehen kurzkettige, niedermolekulare Kohlenwasserstoffe, während bei niedrigen Temperaturen langkettige Paraffine gebildet werden. Je nach Zielprodukt können langkettige Paraffine in den Prozess zur Herstellung von Benzinfraktionen zurückgeführt und dort abgebaut werden. Umgekehrt können langkettige Paraffine durch Rückführung kurzkettiger Paraffine gebildet werden.[107]
Hydrocol-Prozess
[Bearbeiten | Quelltext bearbeiten]
Der Hydrocol-Prozess ist eine Verfahrensvariante, bei der ein mit Kaliumoxid dotierter Magnetitkatalysator in einer Wirbelschicht betrieben wird. Das Verfahren wird bei Temperaturen von 300 bis 350 °C betrieben. Die Abfuhr der Reaktionswärme erfolgt über Kühlrohrbündel, die in die Wirbelschicht eingebracht werden. Eine kommerzielle Anlage in Brownsville (Texas) mit einer Kapazität von 180.000 Jahrestonnen wurde in den 1950er Jahren aus wirtschaftlichen Gründen stillgelegt.[108]
Der Prozess diente der Herstellung von olefinreichen Otto- und Dieselkraftstoffen sowie Oxygenaten aus Erdgas. Die Bildung langkettiger Paraffine musste vermieden werden, da diese zur Kondensation, Katalysatoragglomeration und Wirbelschichtablagerung im Reaktor neigten. Dies stellt eine allgemeine Einschränkung der Fischer-Tropsch-Synthese in Wirbelschichtreaktoren dar.[109] Das Produkt war reich an sauerstoffhaltige Komponenten, darunter Ethanol, Propanol, Acetaldehyd, Aceton, Essig- und Propionsäure.[89]
Synthol- und Sasol-Advanced-Synthol-Verfahren
[Bearbeiten | Quelltext bearbeiten]Eine Reaktionsvariante ist die von den Firmen Sasol und Kellogg entwickelte Synthol-Synthese. Sie ist nicht mit dem von Fischer und Tropsch entwickelten gleichnamigen Verfahren zu verwechseln. Bei dem Verfahren handelt es sich um eine Flugstaubsynthese; bei ihm wird der Katalysator als Pulver mit dem Reaktionsgas eindosiert. Das Verfahren arbeitet bei 25 bar und Temperaturen über 300 °C. Dadurch bilden sich bevorzugt niedermolekulare Kohlenwasserstoffe im Bereich C1 bis C11 mit einem hohen Anteil an Olefinen.[104] Das Verhältnis Kohlenstoffmonoxid zu Wasserstoff beträgt circa 1:2.[15] Es handelt sich um ein Hochtemperatur-Fischer-Tropsch-Verfahren, das zum Sasol-Advanced-Synthol-Verfahren (SAS) weiterentwickelt wurde.
Sasol rüstete 1999 die 16 ursprünglichen Synthol-Reaktoren in Sasol 2 und 3 auf vier 10,7-Meter- und vier 8,0-Meter-SAS-Reaktoren um. Mit dem 10,7-Meter-Reaktor lassen sich 22.000 Barrel pro Tag produzieren, etwa das Zehnfache des ursprünglichen Synthol-Reaktors.[110]
Produkte
[Bearbeiten | Quelltext bearbeiten]
Bei der Fischer-Tropsch-Synthese entstehen keine reinen Endprodukte, sondern eine Art synthetisches Rohöl. Es wird oft als „Syncrude“ bezeichnet, um die Ähnlichkeit mit Rohöl (engl. „crude“) zu betonen. Die Zusammensetzung des Syncrude hängt von der verwendeten Technologie, dem Katalysator, dem Synthesereaktor, den Betriebsbedingungen und dem Deaktivierungsgrad des Katalysators ab.[111]
Die Fischer-Tropsch-Produkte enthalten reine Kohlenwasserstoffe wie Paraffine und Olefine, sowie sauerstoffhaltige Verbindungen wie Alkohole, Aldehyde, Carbonsäuren, Ester und Ketone. Die Produkte sind überwiegend linear mit einem hohen Anteil an n-Paraffinen und α-Olefinen. Ein Niedrigtemperatur-Fischer-Tropsch-Produkt enthält beispielsweise rund 10–15 % Flüssiggase wie Propan und Butane, 50 % Benzin, 28 % Kerosin, 6 % Weichparaffin (Paraffingatsch) und 2 % Hartparaffine. Die Kettenlängenverteilung der während der Reaktion gebildeten Kohlenwasserstoffe folgt einer Schulz-Flory-Verteilung.[112]
Die Wahrscheinlichkeit des Kettenwachstums auf dem Katalysator bestimmt die Kettenlängenverteilung der Produkte. Diese Kettenwachstumswahrscheinlichkeit wird als α-Wert bezeichnet. Dieser ist als Verhältnis der Kettenwachtstumsrate (rp) zur Summe der Kettenwachstums- und Kettenabbruchrate (rt) definiert.
Bei konstanten Betriebsbedingungen liefert der α-Wert ein Maß für die Wahrscheinlichkeit, dass der Katalysator eher die Kettenfortpflanzung als den Kettenabbruch katalysiert.[111] Die Kettenlängenverteilung kann durch folgende Gleichung beschrieben werden:
- ,
wobei Wn der Gewichtsanteil der Kohlenwasserstoffmoleküle mit n Kohlenstoffatomen ist. Im Allgemeinen wird α durch den Katalysator und die spezifischen Prozessbedingungen bestimmt. Durch Variation der Prozessbedingungen und des Designs des Katalysators lässt sich die Selektivität zu verschiedenen Produkten, etwa Olefinen als Rohstoffe für die chemische Industrie, steuern. Je nach Katalysator und Betriebsbedingungen weicht die Kettenlängenverteilung der Produkte zum Teil erheblich von der Schulz-Flory-Verteilung ab. Im Gegensatz zu anderen Polymerisationsreaktionen wird das Monomer zunächst an der Katalysatoroberfläche aus den Reaktanten erzeugt. Weiterhin hängen die Raten der Oberflächenreaktionen von der Kettenlänge ab, und die Primärprodukte können Sekundärreaktionen unterliegen, die die Produktverteilung beeinflussen.[79]
Einfluss der Gaszusammensetzung
[Bearbeiten | Quelltext bearbeiten]Sowohl bei der Normal- als auch bei der Mitteldrucksynthese ist das Verhältnis von Kohlenstoffmonoxid zu Wasserstoff etwa 1 : 2. Daher sollten bei der Fischer-Tropsch-Synthese nach der Gleichung
nur Olefine entstehen, etwa Butene gemäß
- .
Die entstehenden Olefine werden jedoch während der Fischer-Tropsch-Synthese teilweise zu Paraffinen hydriert, wobei das Ausmaß der Hydrierung vom Wasserstoffpartialdruck abhängt. Bei Verwendung von reinem Wassergas mit einem Kohlenstoffmonoxid-Wasserstoff-Verhältnis von 1 : 1 und einem Cobaltkatalysator, der die Wassergas-Shift-Reaktion nicht katalysiert, werden etwa 60 % Olefine gebildet. Bei Verwendung von Spaltgas mit einem Kohlenstoffmonoxid-Wasserstoff-Verhältnis von 1 : 3 sinkt die Olefinbildung auf etwa 12 %. Spaltgas entsteht bei der Reaktion von Methan mit Wasser nach[9]
- .
Einfluss der Temperatur
[Bearbeiten | Quelltext bearbeiten]Bei der Verwendung von Cobaltkatalysatoren beginnt die Bildung von flüssigen Kohlenwasserstoffen bei etwa 160 °C. Bis etwa 200 °C nimmt die Bildung von flüssigen Produkten zu, bei etwa 170 °C erreicht die Bildung von flüssigen Paraffinen schon ein Maximum. Danach steigt die Bildung gasförmiger Produkte an.[9]
Einfluss des Katalysators
[Bearbeiten | Quelltext bearbeiten]Durch die Wahl des katalytisch aktiven Metalls, meist Cobalt oder Eisen, sowie des Katalysatorträgers und der Promotoren kann die Aktivität und Selektivität des Katalysators in weiten Bereichen beeinflusst werden. Der ursprüngliche Fischer-Tropsch-Katalysator enthielt Cobalt als katalytisch aktive Komponente, Kieselgur als Träger und Thorium(IV)-oxid als Promotor. Auf Vorschlag von Otto Roelen wurde später Magnesiumoxid als weiterer Promotor eingesetzt. Ein Katalysator mit 100 Teilen Cobalt, 200 Teilen Kieselgur, 5 Teilen Thoriumoxid und 10 Teilen Magnesiumoxid zeigte einen Umsatz von 100 %. Wurde das Thoriumoxid vollständig durch Magnesiumoxid ersetzt oder umgekehrt, sank der Umsatz auf 90 bis 92 %.[9]
Weiterverarbeitung der Produkte
[Bearbeiten | Quelltext bearbeiten]In den frühen Fischer-Tropsch-Anlagen folgte auf jede Synthesestufe eine Trennstufe. Mittels Sprühkondensatoren wurde das Produkt auf Umgebungstemperatur abgekühlt und eine Ölfraktion erhalten. Das nicht kondensierte Gas wurde an Aktivkohle adsorbiert und von dort durch Verdampfung zurückgewonnen. Durch Destillation wurde das desorbierte Produkt in Leichtbenzin und Flüssiggas getrennt.
Wie Rohöl muss das Produkt der Fischer-Tropsch-Synthese raffiniert werden, um marktfähige Endprodukte zu erzeugen. Dies erfordert eine Reihe von Verarbeitungsschritten, etwa Hydrocracken oder Hydrotreating.[113] Ziel des Hydrocrackens ist es, langkettige n-Paraffine selektiv in Mitteldestillate umzuwandeln, während bereits im Produkt enthaltenen Mitteldestillate nicht weiter gecrackt werden sollen.
| Bezeichnung | Katalysatorwachs | Ölkondensat | Benzin* | Flüssiggas | Olefingehalt |
|---|---|---|---|---|---|
| Anteil am Gesamtprodukt [%] | 2 | 40 | 50 | 8 | |
| Kohlenstoffdioxid | 10–30 | ||||
| Kohlenstoffmonoxid | 1–3 | ||||
| Wasserstoff | 2–4 | ||||
| Methan | 2–3 | ||||
| Ethan, Ethen | 1–2 | ||||
| Propan, Propen | 1 | 15–20 | 43 | ||
| C4 | 5–15 | 20–40 | |||
| C5 | 15–20 | 10–20 | 37 | ||
| C6 – 180°C Fraktion | 1–3 | 20–25 | 3–5 | ||
| Kogasin I | 35–40 | 18 | |||
| Kogasin II | 30–35 | 8 | |||
| Paraffingatsch | 20–30 | 20 | 0 | ||
| Hartwachs | 70–80 | 1 | 0 |
*: Da der Rest hauptsächlich aus gasförmigen Produkten besteht, summiert sich das Benzin nicht zu 100 % auf.
Fischer-Tropsch-Wachse bestehen hauptsächlich aus linearen Paraffinen, die durch Hydroisomerisierung an einem bifunktionellen Zeolithkatalysator isomerisiert werden können. Durch die Isomerisierung wird der Stockpunkt gesenkt, so dass die höhermolekularen Fischer-Tropsch-Produkte besser als Schmierstoffe eingesetzt werden können.[115] Weiterhin können n-Paraffine durch Harnstoff-Extraktiv-Kristallisation von iso-Paraffinen getrennt werden.
Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]
Zur Untersuchung von Reaktionen an heterogenen Katalysatoren, Katalysatoroberflächen und der reaktiven Spezies gibt es verschiedene Analysen- und Untersuchungsmethoden, wie die Markierung mit radioaktiven Molekülen oder Mößbauer- und Röntgenphotoelektronenspektroskopie sowie viele weitere Methoden. Ursprünglich wurde angenommen, dass die Bildung von Kohlenwasserstoffen über die Hydrierung von oberflächengebundenen Metallcarbidspezies abläuft. Durch mechanistische Untersuchungen mit 14C-markiertem Kohlenstoffmonoxid konnte nachgewiesen werden, dass dieser Mechanismus nur einen kleinen Beitrag zur Gesamtreaktion leisten konnte.[116] In der Folgezeit wurden verschiedene Mechanismen vorgeschlagen und untersucht, wobei der Einbau von 14C-markierten Komponenten und die nachfolgende Untersuchung der 14C-Verteilung in den Produkten eine oft angewandte Untersuchungsmethode darstellten.
Ebenfalls wurde die Zugabe von Olefinen und Acetylenen auf die Reaktion untersucht. Durch Zugabe von geringen Mengen Ethin zum Synthesegas bilden sich noch bei 120 °C nennenswerte Mengen an Fischer-Tropsch-Produkten. Die α-Werte nehmen mit zunehmender Ethinzugabe ab, was darauf hindeutet, dass Ethin als Kettenstarter wirkt. Bei Verwendung von Ethin mit Cobaltkatalysatoren werden selektiv C3- und C5-Oxygenate gebildet, wahrscheinlich durch Hydroformylierung von adsorbierten ungesättigten C2- und C4-Spezies, die von Ethin gebildet wurden.[117]
Der Reaktionsmechanismus lässt sich in die Schritte Chemisorption von Kohlenstoffmonoxid und dissoziative Chemisorption von Wasserstoff, Kettenwachstum, Wasserstoffübertragung, Hydrogenolyse und Desorption unterteilen. Analog zur Hydroformylierung wird angenommen, dass oberflächengebundene Metallcarbonyle Teil des katalytisch aktiven Systems sind. Der Kettenwachstumsschritt könnte über die Bildung von Acylkomplexen und deren anschließende Hydrierung zum Alkylkomplex verlaufen. In die Metall-Alkyl-Bindung könnte ein weiteres Molekül Kohlenstoffmonoxid insertieren.[15]

- Mögliche Schritte der Fischer-Tropsch-Reaktion[118]
Kinetische Untersuchungen in Rohrreaktoren, mit denen bei anderen heterogen-katalysierten Reaktion der geschwindigkeitsbestimmende Schritt, etwa die chemische Reaktion, die Diffusion durch die Grenzschicht oder die Porendiffusion, bestimmt werden konnte, führten bei der Untersuchung der Fischer-Tropsch-Synthese zu keinem eindeutigen Ergebnis.[15] Das Reaktionsnetzwerk besteht aus einer Reihe von komplexen, teilweise reversiblen chemischen und Transportreaktionen. Es wird außerdem angenommen, dass sich das katalytisch aktive Zentrum unter Reaktionsbedingungen durch Chemisorption der Reaktanden ausbildet und sich über die Länge der Katalysatorschüttung ändert.[15] Durch Untersuchungen in gradientenfreien Reaktoren wurde eine Aktivierungsenergie von 93 bis 95 kJ mol−1 und ein inhibierender Einfluss der Kohlenstoffmonoxidkonzentration gezeigt.[119][120] Bei kinetischen Untersuchungen in gradientenfreien Spinning-Basket-Reaktoren wurde die Bildung einer oberflächengebundenen Methylenspezies, die durch Hydrierung von chemisorbierten Kohlenstoffmonoxid entsteht, als geschwindigkeitsbestimmender Schritt identifiziert. Als ein solcher Schritt der Wassergas-Shift-Reaktion gilt die Bildung einer oberflächengebundenen Formylspezies.[121]
Anderson-Emmett-Mechanismus
[Bearbeiten | Quelltext bearbeiten]In Untersuchungen von Robert B. Anderson und Paul Hugh Emmett wurde herausgefunden, dass an Metallzentren chemisorbiertes Kohlenstoffmonoxid durch Wasserstoff zu einem enolischen Primärkomplex der Art M=CH(OH) (M = Metall) hydriert wird. Das Kettenwachstum erfolgt durch Kohlenstoff-Kohlenstoff-Verknüpfung zweier benachbarter Enole unter Wasserabspaltung. Durch Hydrierung dieser Zwischenstufe entsteht ein Methylhydroxycarbenkomplex, der wiederum für den Aufbau einer Kohlenstoffkette mit benachbarten Enolkomplexen unter Wasserabspaltung bereitsteht. Man erkannte, dass 14C-markiertes 1-Propanol schnell in den entstehenden Kohlenwasserstoff eingebaut wird. Dies wurde als Hinweis auf intermediäre Enolkomplexe gewertet.[122]
Pichler-Schulz-Mechanismus
[Bearbeiten | Quelltext bearbeiten]Beim Pichler-Schulz-Mechanismus ist das Kettenwachstum durch Insertion von Kohlenstoffmonoxid in eine Metall-Alkyl-Bindung mit anschließender Hydrierung zum um eine CH2-Gruppe gewachsenen Alkylrest bestimmt. Dieser Mechanismus impliziert, dass die Insertion und die anschließende Hydrierung schnell im Vergleich zur Kettenabbruchreaktion verlaufen. Unterstützt wird dieser Mechanismus unter anderem durch das Verschwinden der Infrarot-Bande von adsorbiertem Kohlenstoffmonoxid während der Fischer-Tropsch-Reaktion.[123]
Sachtler-Biloen-Mechanismus
[Bearbeiten | Quelltext bearbeiten]Neuere Studien scheinen einen Mechanismus über den Zerfall von chemisorbierten Kohlenstoffmonoxid in adsorbierte C1-Spezies und Sauerstoff zu unterstützen.[124] Hinweise darauf basieren auf dem leichten Einbau von voradsorbierten markierten Kohlenstoffen in die entstehende Kohlenwasserstoffkette. Das Kettenwachstum erfolgt dabei nach einem Gaube–Maitlis-Modell über oberflächengebundene Alkyliden- oder Alkylidin-Spezies.[124]
Umweltauswirkungen
[Bearbeiten | Quelltext bearbeiten]Die Umweltauswirkungen der Fischer-Tropsch-Synthese hängen in erster Linie von den verwendeten Rohstoffen ab. Sie ergeben sich unter anderem aus dem Wasserverbrauch, den Kohlenstoffdioxidemissionen und der geringeren Energieeffizienz im Vergleich zur direkten Verbrennung. Verfahren zur Minimierung der Umweltauswirkungen, wie die Speicherung von Kohlenstoffdioxid, verringern die Energieeffizienz weiter. Der Aufwand für den Transport der Rohstoffe zur Fischer-Tropsch-Anlage wirkt sich bei Verfahren wie Biomass-to-Liquid oder Waste-to-Liquid negativ auf die Umwelt aus. Der Vergleich der Effizienz der verschiedenen Fischer-Tropsch-Prozesse für die Erzeugung flüssiger Kraftstoffe erfolgt oft mit einer Well-to-Wheel-Analyse (etwa: vom Bohrloch/Schacht-zum-Rad/Fahrzeug). Dabei wird die Energieeffizienz der gesamten Wirkungskette von der Gewinnung der Primärenergie über ihre Umwandlung und Übertragung bis hin zu ihrer Verteilung und Endnutzung betrachtet.[125]
Coal-to-Liquid
[Bearbeiten | Quelltext bearbeiten]Der Rohstoff Kohle verbraucht Wasser für die Kohlevergasung und die Wassergas-Shift-Reaktion sowie für die Kühlung und Dampferzeugung. Zusätzlich fallen erhebliche Abwassermengen an. Zudem ist Wasser oft dort knapp, wo Kohle reichlich vorhanden ist. Beim Einsatz von Braunkohle aus Montana werden beispielsweise pro Tonne Fischer-Tropsch-Kraftstoff etwa 6,25 Tonnen Braunkohle und weitere 6,25 Tonnen Wasser benötigt.[126] Je nach Kohlesorte und Prozess steigt der Wasserbedarf auf 10 bis 12 Tonnen Wasser pro Tonne Fischer-Tropsch-Kraftstoff.[127]
Der Gesamtwirkungsgrad des CtL-Verfahrens ist gering, da ein großer Teil der Kohle energetisch für die Synthesegaserzeugung und die zusätzlich notwendige Wasserstofferzeugung verwendet wird. Infolgedessen steigen die Treibhausgasemissionen und verschlechtern die CO2-Bilanz. Techniken zur Speicherung des Kohlenstoffdioxids verringern die Effizienz weiter. So verarbeitete die Sasol in Secunda 2006 etwa 42 Millionen Tonnen Kohle geringer Qualität zu etwa 6,4 Millionen Tonnen Flüssigprodukten, was einem Wirkungsgrad von circa 27 % bezogen auf den Wärmeinhalt der Kohle entspricht. Darüber hinaus produzierte Secunda im Jahr 2001 etwa 4055 Gigawattstunden methanreiches Gas, dessen Heizwert den Wirkungsgrad des Verfahrens erhöht.[128]
Gas-to-Liquid
[Bearbeiten | Quelltext bearbeiten]Der Wasserbedarf des GtL-Verfahrens ist geringer als der des CtL-Verfahrens, da die partielle Verbrennung des Methans direkt das notwendige Verhältnis von Kohlenstoffmonoxid zu Wasserstoff liefert und der Wasserbrauch der Wassergas-Shift-Reaktion entfällt. Die Energieeffizienz ist ebenfalls besser als beim CtL-Verfahren. Die Energieeffizienz errechnet sich aus dem Verhältnis der Verbrennungsenthalpie der Rohstoffe zu dem der Produkte bei der Verbrennung. Die GtL-Anlage der Shell in Bintulu verarbeitete 566.000 Kubikmeter Erdgas pro Tag zu etwa 800 Tonnen Mitteldestillat und 800 Tonnen Wachse pro Tag. Der Quotient der Verbrennungsenthalpien von Produkten zu Rohstoffen beträgt 54 % und entspricht der Energieeffizienz des Verfahrens. Für die GtL-Anlage Oryx, die auf der Umwandlung von magerem Erdgas als Einsatzstoff basiert, liegt die Energieeffizienz bei circa 52 %.[128]
Biomass-to-Liquid
[Bearbeiten | Quelltext bearbeiten]Die Bewertung von Biomass-to-Liquid-Anlagen ist aufgrund des breiten Spektrums von Einsatzstoffen schwierig. Neben den Verlusten, die sich aus der Sammlung und dem Transport der Biomasse ergeben, spielt besonders der Feuchtigkeitsgehalt des Ausgangsmaterials eine entscheidende Rolle. Für die Vergasung sollte das Material eine Restfeuchte von unter 30 % aufweisen. So unterscheiden sich landwirtschaftliche Abfälle, Holz, Gülle und Klärschlämme erheblich in ihrem Feuchtigkeitsgehalt und beeinflussen damit auch den Gesamtwirkungsgrad des Verfahrens.[129] Im Bezug auf die Treibhausgasreduzierung erzielen Fischer-Tropsch-Kraftstoffe auf Basis von Pflanzen- und Holzrückständen ein Einsparpotential von 60 bis 120 % im Vergleich zu herkömmlichen Kraftstoffen. Biokraftstoffe der ersten Generation wie Biodiesel oder Bioethanol können Erdölprodukten nur in bestimmten Anteilen beigemischt werden. Fischer-Tropsch-Kraftstoffe hingegen sind identisch mit Erdölprodukten und erfordern für die Lagerung, den Transport und die Nutzung keine Änderungen an der bestehenden Infrastruktur oder der Fahrzeugtechnik.
Power-to-Liquid
[Bearbeiten | Quelltext bearbeiten]Bei Power-to-Liquid-Verfahren ist der Primärenergieverbrauch für die Herstellung von Fischer-Tropsch-Kraftstoffen bei gleicher Reichweite um ein Vielfaches höher als bei Technologien wie der Brennstoffzelle oder Elektroautos. Der niedrige Gesamtwirkungsgrad ergibt sich aus den Wirkungsgradverlusten bei der Wasserelektrolyse und der Kohlenstoffdioxidgewinnung zusätzlich zu denen bei der Fischer-Tropsch-Synthese.[130]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Arno de Klerk: Fischer-Tropsch Refining. Wiley-VCH, 2011, ISBN 978-3-527-32605-1 (englisch).
- Peter M. Maitlis, Arno de Klerk (Hrsg.): Greener Fischer-Tropsch Processes for Fuels and Feedstocks. Wiley-VCH, Weinheim, 2013, ISBN 978-3-527-32945-8 (englisch).
- Isabel Suárez-Ruiz, Maria Antonia Diez, Fernando Rubiera: New Trends in Coal Conversion. 2019, Elsevier, ISBN 978-0-08-102201-6 (englisch).
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Franz Fischer, Hans Tropsch: Über die Herstellung synthetischer Ölgemische (Synthol) durch Aufbau aus Kohlenoxyd und Wasserstoff. In: Brennstoff-Chem. Band 4, 1923, S. 276–285.
- ↑ Franz Fischer, Hans Tropsch: Über die direkte Synthese von Erdöl-Kohlenwasserstoffen bei gewöhnlichem Druck. (Erste Mitteilung). In: Berichte der deutschen chemischen Gesellschaft (A and B Series). Band 59, 1926, S. 830–831, doi:10.1002/cber.19260590442.
- ↑ G. Henrici-Olivé: The Chemistry of the Catalyzed Hydrogenation of Carbon Monoxide. Springer-Verlag, Berlin 1984, ISBN 3-540-13292-9, S. 144–145.
- ↑ F. Fischer, H. Pischler: Verfahren zur Herstellung fester aliphatischer Kohlenwasserstoffe. DRP Patent 705.528, 30. April 1941, eingereicht am 10. Mai 1938. (pdf)
- ↑ a b Raymond G. Stokes: The Oil Industry in Nazi Germany, 1936–1945. In: The Business History Review. 1985, 59.2, S. 254–277, JSTOR:3114932, doi:10.2307/3114932.
- ↑ Christoph Janiak, Thomas M. Klapötke, Hans-Jürgen Meyer, Erwin Riedel: Moderne anorganische Chemie. 2003, ISBN 3-11-017838-9, S. 769.
- ↑ a b c d e Arno de Klerk: Industrial Fischer-Tropsch Facilities. In: Arno de Klerk: Fischer-Tropsch Refining. Wiley-VCH, 2011, ISBN 978-3-527-32605-1, S. 117–139.
- ↑ L.P. Dancuart, A.P. Steynberg: Fischer-Tropsch Based GTL Technology: a New Process? . In: Studies in Surface Science and Catalysis, Volume 163. ScienceDirect, 2007, S. 379–399.
- ↑ a b c d e f g h i j k l m Friedrich Asinger: Chemie und Technologie der Paraffin-Kohlenwasserstoffe. Akademie Verlag, 1956, S. 64–85.
- ↑ Japanese fuels and lubricants – Progress in the synthesis of liquids fuels from coal (U.S. Navel Technical Mission to Japan, February 1946) Fischer-Tropsch-Archiv, abgerufen am 22. August 2023.
- ↑ Frederick Pope: Report on the Japanese Chemical Industry. In: Far Eastern Survey, Vol. 18, No. 25. Institute of Pacific Relations, 1949, S. 295–298.
- ↑ Mark E. Dry: Practical and theoretical aspects of the catalytic Fischer-Tropsch process. In: Applied Catalysis A: General. 138.2, 1996, S. 319–344, doi:10.1016/0926-860x(95)00306-1.
- ↑ R. H. K. Vietor: The Synthetic Liquid Fuels Program: Energy Politics in the Truman Era. In: Business History Review. 54.1, 1980, S. 1–34, doi:10.2307/3114274.
- ↑ Franz Kainer: Die Kohlenwasserstoff-Synthese nach Fischer-Tropsch. Springer Verlag, 1950, ISBN 978-3-642-49125-2, S. 217.
- ↑ a b c d e f g h i j k F. Benthaus u. a.: Rohstoff Kohle. Eigenschaften, Gewinnung, Veredelung. 1. Auflage. Verlag Chemie, Weinheim 1978, ISBN 3-527-25791-8, S. 43.
- ↑ a b Zwanzig Minuten Kohlenklau. In: Spiegel Online. 5. Dezember 1947, abgerufen am 1. April 2023.
- ↑ a b Stellungnahme der Industrie- und Handelskammer, Dortmund, (E. Beckhäuser) zur Demontage der Fischer-Tropsch-Synthese-Werke, Internetportal Westfälische Geschichte, abgerufen am 21. August 2023.
- ↑ Hoesch-Werkzeitschrift Werk und Wir Ausgabe 3/1954, S. 94–97. ThyssenKrupp-Archiv, abgerufen am 2. Juli 2023.
- ↑ Aus strategischen Gründen. In: Spiegel Online. 22. Juni 1949, abgerufen am 1. April 2023.
- ↑ Horst Heininger: Der Nachkriegszyklus der westdeutschen Wirtschaft, 1945–1950. Verlag Die Wirtschaft, 1959, S. 204–205.
- ↑ Bettelei um Kohle Der Spiegel vom 6. Februar 1951.
- ↑ Marc Zeller: Intellektuelle Reparationen und westdeutscher Wiederaufstieg. Die Chemische Industrie 1945–1955. Dissertation. Justus-Liebig-Universität, Gießen 2009, S. 171 f.
- ↑ Manfred Rasch: Industrielle thermisch-chemische Kohlenveredlung. In: Günter Bayerl: Braunkohleveredelung im Niederlausitzer Revier. 50 Jahre Schwarze Pumpe. Waxmann Verlag, 2009, S. 69–72.
- ↑ Manfred Rasch: Industrielle thermisch-chemische Kohlenveredlung. In: Günter Bayerl: Braunkohleveredelung im Niederlausitzer Revier. 50 Jahre Schwarze Pumpe. Waxmann Verlag, 2009, S. 69–72.
- ↑ a b Guido D. Frey, Barbara Köhler (Redaktion): Historische Stätte der Chemie: Otto Roelen. Gesellschaft Deutscher Chemiker, 2013, S. 11–18.
- ↑ Rainer Karlsch: Allein bezahlt? Die Reparationsleistungen der SBZ/DDR 1945–53. Ch. Links Verlag, 1993, S. 121.
- ↑ Christa-Maria Eulitz, Sigrid Scheuermann, Hans-Joachim Thier: Brockhaus ABC Chemie, Band 1. F.A. Brockhaus, 1965, S. 416.
- ↑ a b Vom Erdöl zu Kraft- und Schmierstoffen Deutsches Chemie-Museum Merseburg, abgerufen am 21. August 2023.
- ↑ Jochen Bethkenhagen: DDR und Osteuropa. Wirtschaftssystem, Wirtschaftspolitik, Lebensstandard. Ein Handbuch. Leske-Verlag, 1981, S. 68.
- ↑ Holger Watter: Regenerative Energiesysteme. Grundlagen, Systemtechnik und Analysen ausgeführter Beispiele nachhaltiger Energiesysteme. Springer-Verlag, 2015, S. 266.
- ↑ Texas A&M University (2003): Synthetic Fuel Production in Prewar and World War II Japan Fischer-Tropsch-Archiv, abgerufen am 23. August 2023.
- ↑ Heike Mall, Roger Just: Baikalsee. Handbuch für Reisen in die Baikalregion. BoD, 2017, S. 190–191.
- ↑ Павел Лурье: Великая Россия. Все города от Калининграда до Владивостока. Эксмо, 2017 г., S. 262 (russ.), ISBN 978-5-699-79175-0.
- ↑ Георгий Александрович Куманев: Говорят сталинские наркомы. Издательство Русич, 2005 г., S. 609 (russ.), ISBN 5-8138-0660-1.
- ↑ Bogdan Musial: Demontaż na rozkaz Stalina. 1945 – sowieckie trofea kosztem Polski. Uważam Rze Historia, Warszawa, maj 2012, S. 28–31 (poln.). ISSN 2084-8633.
- ↑ British Library, Lending Division u. a.: Russian Journal of Physical Chemistry, Band 65. Chemical Society (Great Britain), 1991, S. 633.
- ↑ Rosneft pilots Fischer Tropsch gas-to-liquids catalysts at Angarsk plant MRC, abgerufen am 23. August 2023.
- ↑ USSR Report Chemistry No. 105 / FBIS 9. August 1983 U.S. Defense Technical Information Center, abgerufen am 23. August 2023.
- ↑ Novokuybyshevsk Britannica, abgerufen am 23. August 2023.
- ↑ Novokuibyshevsk Petrochemical Company Rosneft, abgerufen am 23. August 2023.
- ↑ Angarsk Plant of Catalysts and Organic Synthesis celebrates 70 years of production activity Tek-all vom 3. November 2022, abgerufen am 23. August 2022.
- ↑ A.S. Govorin, N.D. Gubanov, N. P. Konovalov: Esterification of tall oil fatty acids using ion exchange resins in order to produce energy-efficient engine oil. Irkutsk National Research Technical University, Russia, 2019. IOP Conference Series - Earth and Environmental Science, abgerufen am 23. August 2022.
- ↑ a b Hazel C. Anderson: Bibliography of the Fischer-Tropsch Synthesis and Related Processes. In: Bulletin 544 Bureau of Mines. U.S. Government Printing Office, 1954, S. 4.
- ↑ Les Etablissements Kuhlmann, une société de chimie minérale Société Chimique de France, abgerufen am 24. August 2023.
- ↑ B. H. Davis, M. L. Occelli (Hrsg.): Fischer-Tropsch Synthesis, Catalysts and Catalysis. In: Studies in surface science and catalysis 163. Elsevier, 2006, S. 2.
- ↑ First Chemical Co-Products Of Hydrocarbon Synthesis Will Soon Be Available. In: Chemical & Engineering News. 27.51, 1949, S. 3775–3776, doi:10.1021/cen-v027n051.p3775.
- ↑ Franz Spausta: Treibstoffe für Verbrennungsmotoren. Springer-Verlag, Wien 1939, ISBN 978-3-7091-5161-7, S. 87.
- ↑ André Steynberg, Mark Dry: Fischer-Tropsch Technology. Volume 152 of Studies in Surface Science and Catalysis. Elsevier, 2004, ISBN 0-444-51354-X, S. 722.
- ↑ a b c Mark E. Dry: Fischer-Tropsch Synthesis – Industrial. In: Encyclopedia of Catalysis. John Wiley & Sons, 2010, S. 1–55, doi:10.1002/0471227617.eoc094
- ↑ Wolfgang Drechsler: Petrochemie-Konzern Sasol: Der heimliche Ölkonzern aus Südafrika. In: handelsblatt.com. 30. August 2006, abgerufen am 1. April 2023.
- ↑ Sven Kreidelmeyer (Projektleitung) u. a.: Studie im Auftrag des Bundesministeriums für Wirtschaft und Energie. Kosten und Transformationspfade für strombasierte Energieträger. Endbericht zum Projekt „Transformationspfade und regulatorischer Rahmen für synthetische Brennstoffe“. Prognos AG, 2020, S. 25, Fußnote 15.
- ↑ Sasol to hold off on China CTL plant pending review Reuters, abgerufen am 22. Juni 2023.
- ↑ Synfuels China demonstrates First Fischer-Tropsch products from the new Shenhua Ningxia Coal-to-Liquids plant Syngaschem B.V., abgerufen am 22. Juni 2023.
- ↑ Mark E. Dry: High quality diesel via the Fischer-Tropsch process – a review. In: Journal of Chemical Technology & Biotechnology. Band 77, 2002, S. 43–50, doi:10.1002/jctb.527.
- ↑ Uzbekistan GTL complex starts production of synthetic jet fuel Palladian Publications Ltd., abgerufen am 22. Juni 2023.
- ↑ Uzbekistan launches first gas-to-liquids plant Reuters, abgerufen am 22. Juni 2023.
- ↑ Uzbek GTL plant reaches the finish line Natural Gas World, abgerufen am 22. Juni 2023.
- ↑ Botswana: Coal to Liquids deal expected by next December Dikgang Publishing Company, abgerufen am 22. Juni 2023.
- ↑ Coal to Liquid (CTL) Market GlobeNewswire, abgerufen am 22. Juni 2023.
- ↑ José María Sánchez-Hervás, Gregorio Molina Moya, Isabel Ortiz-González: Current status of coal gasification. In: Isabel Suárez-Ruiz, Maria Antonia Diez, Fernando Rubiera: New Trends in Coal Conversion. 2019, Elsevier, ISBN 978-0-08-102201-6, S. 175–202.
- ↑ Roger Drinnon: C-17 flight uses synthetic fuel blend. 18. Dezember 2007, abgerufen am 12. Oktober 2013.
- ↑ Hopper T. Smith: Ace in the Hole: Fischer-Tropsch Fuels and National Security. In: Army War Coll. Carlisle Barracks PA. 2010.
- ↑ Michael Engel, Lukas Rohleder: Alternative Flugkraftstoffe – Chancen und Herausforderungen. In: Internationales Verkehrswesen. Heft 1, März 2015 (67. Jahrgang), S. 24–27.
- ↑ B. Kamm: Production of Platform Chemicals and Synthesis Gas from Biomass. In: Angewandte Chemie International Edition. Band 46, 2007, S. 5056–5058, doi:10.1002/anie.200604514.
- ↑ M. Höök, D. Fantazzini, A. Angelantoni, S. Snowden: Hydrocarbon liquefaction: viability as a peak oil mitigation strategy. In: Phil. Trans. R. Soc. A. 372.2006, 2014, S. 20120319 doi:10.1098/rsta.2012.0319.
- ↑ D. Glavin u. a.: Extraterrestrial amino acids in the Almahata Sitta meteorite. In: Meteoritics & Planetary Science. 45.10–11, 2010, S. 1695–1709, doi:10.1111/j.1945-5100.2010.01094.x.
- ↑ M. E. Kress, A. G. G. M. Tielens: The role of Fischer-Tropsch catalysis in solar nebula chemistry. In: Meteoritics & Planetary Science. 36.1, 2001, S. 75–91; doi:10.1111/j.1945-5100.2001.tb01811.x.
- ↑ Y. Chen u. a.: Carbon-based catalysts for Fischer–Tropsch synthesis. In: Chemical Society Reviews. 50.4, 2021, S. 2337–2366, doi:10.1039/d0cs00905a.
- ↑ M. Martinelli u. a.: An overview of Fischer-Tropsch Synthesis: XtL processes, catalysts and reactors. In: Applied Catalysis A: General. Band 608, 2020, S. 117740, doi:10.1016/j.apcata.2020.117740.
- ↑ a b c Roberto Zennaro u. a.: Syngas: The Basis of Fischer–Tropsch. In: Peter M. Maitlis, Arno de Klerk (Hrsg.): Greener Fischer-Tropsch Processes for Fuels and Feedstocks. Wiley-VCH, Weinheim 2013, ISBN 978-3-527-32945-8, S. 19–49.
- ↑ V. Dieterich u. a.: Power-to-liquid via synthesis of methanol, DME or Fischer–Tropsch-fuels: a review. In: Energy & Environmental Science. 13.10, 2020, S. 3207–3252, doi:10.1039/d0ee01187h.
- ↑ H. Hao u. a.: Coal-derived alternative fuels for vehicle use in China: A review. In: Journal of Cleaner Production. Band 141, 2017, S. 774–790, doi:10.1016/j.jclepro.2016.09.137.
- ↑ a b M. Zhang, J. Ren, Y. Yu: Insights into the Hydrogen Coverage Effect and the Mechanism of Fischer–Tropsch to Olefins Process on Fe5C2 (510). In: ACS Catalysis. 10.1, 2019, S. 689–701, doi:10.1021/acscatal.9b03639.
- ↑ David Graf, Xhesika Koroveshi, Thomas Kolb, Reinhard Rauch: Konzepte zur Integration erneuerbarer synthetischer Kraftstoffe in einen bestehenden Raffinerieverbund. In: Chemie Ingenieur Technik. 94.3, 2022, S. 267–280, doi:10.1002/cite.202100154.
- ↑ a b Mark E. Dry: The Fischer–Tropsch process: 1950–2000. In: Catalysis Today. 71.3–4, S. 227–241, doi:10.1016/s0920-5861(01)00453-9.
- ↑ D. B. Pal, R. Chand, S. N. Upadhyay, P. K. Mishra: Performance of water gas shift reaction catalysts: A review. In: Renewable and Sustainable Energy Reviews. Band 93, 2018, S. 549–565, doi:10.1016/j.rser.2018.05.003.
- ↑ INFRA M100 plant near Houston (Texas, USA)
- ↑ a b c D. A. Wood, C. Nwaoha, B. F. Towler: Gas-to-liquids (GTL): A review of an industry offering several routes for monetizing natural gas. In: Journal of Natural Gas Science and Engineering. Band 9, 2012, S. 196–208, doi:10.1016/j.jngse.2012.07.001.
- ↑ a b O. O. James, B. Chowdhury, M. A. Mesubi, S. Maity: Reflections on the chemistry of the Fischer–Tropsch synthesis. In: RSC Advances. 2.19, 2012, S. 7347, doi:10.1039/c2ra20519j.
- ↑ Jay J. Cheng, Govinda R. Timilsina: Advanced Biofuel Technologies: Status and Barriers. Knowledge for Change Program (KCP), Policy Research Working Paper 5411, The World Bank Development Research Group, Environment and Energy Team, September 2010, WPS5411, S. 37–39 (pdf)
- ↑ E. van Steen, M. Claeys: Fischer-Tropsch Catalysts for the Biomass-to-Liquid (BTL)-Process. In: Chemical Engineering & Technology. 31.5, 2008, S. 655–666, doi:10.1002/ceat.200800067.
- ↑ Biomasse-Kraftwerk Güssing ist insolvent. In: burgenland.orf.at. 22. Juli 2013, abgerufen am 2. April 2023.
- ↑ Dr. Ulrik Neupert: E-Fuels. In: Das Fraunhofer-Institut für Naturwissenschaftlich-Technische Trendanalysen. Juni 2023, abgerufen am 26. Mai 2024.
- ↑ Dr. Ulf Neuling & Leon Berks: E-Fuels zwischen Wunsch und Wirklichkeit. Agora Verkehrswende, August 2023, abgerufen am 26. Mai 2024.
- ↑ Sean M.W. Wilson: High purity CO2 from direct air capture using a single TVSA cycle with Na-X zeolites. Science Direct, 1. August 2022, abgerufen am 26. Mai 2024 (englisch).
- ↑ Wissenschaftlicher Dienst des Deutschen Bundestages: Erkenntnisse aus der Erprobung von Technologien zur CO2-Abscheidung und CO2-Speicherung (CCS) in Deutschland. 11. Juli 2018, abgerufen am 26. Mai 2024.
- ↑ M. Vannice: The catalytic synthesis of hydrocarbons from H2/CO mixtures over the group VIII metals I. The specific activities and product distributions of supported metals. In: Journal of Catalysis. 37.3, 1975, S. 449–461, doi:10.1016/0021-9517(75)90181-5.
- ↑ Andrei Y. Khodakov, Wei Chu, Pascal Fongarland: Advances in the Development of Novel Cobalt Fischer-Tropsch Catalysts for Synthesis of Long-Chain Hydrocarbons and Clean Fuels. In: ChemInform. 38, 2007, doi:10.1002/chin.200733255.
- ↑ a b c d e Friedrich Asinger: Einführung in die Petrolchemie. Akademie Verlag, Berlin 1959, S. 24–35.
- ↑ Dragomir B. Bukur, Branislav Todic, Nimir Elbashir: Role of water-gas-shift reaction in Fischer–Tropsch synthesis on iron catalysts: A review. In: Catalysis Today. Band 275, 2016, S. 66–75, doi:10.1016/j.cattod.2015.11.005.
- ↑ S. Storsater, B. Totdal, J. Walmsley, B. Tanem, A. Holmen: Characterization of alumina-, silica-, and titania-supported cobalt Fischer-Tropsch catalysts. In: Journal of Catalysis. Band 236, 2005, S. 139–152, doi:10.1016/j.jcat.2005.09.021.
- ↑ Arno de Klerk: Fischer-Tropsch-Process. In: Kirk-Othmer Encyclopedia of Chemical Technology. 2013, doi:10.1002/0471238961.fiscdekl.a01.
- ↑ Wolfgang A. Herrmann: Metallorganische Aspekte der Fischer-Tropsch-Synthese. In: Angewandte Chemie. Band 94, 1982, S. 118–131, doi:10.1002/ange.19820940205.
- ↑ Wilfried Rähse: Untersuchung der kondensierten Eisenhydroxide. In: Zeitschrift für anorganische und allgemeine Chemie. Band 438, 1978, S. 222–232, doi:10.1002/zaac.19784380124.
- ↑ B.I.O.S. - Final Report No. 447, Item No. 30: Interrogation of Dr. Otto Roelen of Ruhrchemie A.G. Archiviert vom (nicht mehr online verfügbar) am 8. Februar 2012; abgerufen am 3. August 2012.
- ↑ a b c d e Friedrich Asinger: Chemie und Technologie der Paraffin-Kohlenwasserstoffe. Akademie Verlag, 1956, S. 86–122.
- ↑ N. E. Tsakoumis u. a.: Deactivation of cobalt based Fischer–Tropsch catalysts: A review. In: Catalysis Today. 154. 3–4, 2010, S. 162–182, doi:10.1016/j.cattod.2010.02.077.
- ↑ E. de Smit, B. M. Weckhuysen: The renaissance of iron-based Fischer–Tropsch synthesis: on the multifaceted catalyst deactivation behaviour. In: Chemical Society Reviews. 37.12, 2008, S. 2758–2781, doi:10.1039/b805427d.
- ↑ S. Saeidi u. a.: Progress in Reactors for High-Temperature Fischer–Tropsch Process: Determination Place of Intensifier Reactor Perspective. In: International Journal of Chemical Reactor Engineering. 12.1, 2014, S. 639–664, doi:10.1515/ijcre-2014-0045.
- ↑ J. Xu, Y. Yang, Y. W. Li: Fischer–Tropsch synthesis process development: steps from fundamentals to industrial practices. In: Current Opinion in Chemical Engineering. 2.3, 2013, S. 354–362, doi:10.1016/j.coche.2013.05.002.
- ↑ Arno de Klerk: German Fischer–Tropsch Facilities. In: Fischer‐Tropsch Refining. Wiley‐VCH, 2022, S. 117–139, doi:10.1002/9783527635603.ch6.
- ↑ H. Mahmoudi u. a.: A review of Fischer Tropsch synthesis process, mechanism, surface chemistry and catalyst formulation. In: Biofuels Engineering. 2.1, 2017, S. 11–31, doi:10.1515/bfuel-2017-0002.
- ↑ Norma R. Golumbic: Review of Fischer-Tropsch and related Processes for Synthetic Liquid Fuel Production. Bureau of Mines, 1946, Inf. Circ. 7366, S. 7.
- ↑ a b M. Röper: Fischer-Tropsch-Synthesis. In: Wilhelm Keim (Hrsg.): Catalysis in C1 Chemistry. D. Reidel, Dordrecht, 1983, ISBN 90-277-1527-0, S. 41–88.
- ↑ Herbert Kölbel, Milos Ralek: The Fischer-Tropsch Synthesis in the Liquid Phase. In: Catalysis Reviews. Band 21, 1980, S. 225–274, doi:10.1080/03602458008067534.
- ↑ Herbert Kölbel, Paul Ackermann: Großtechnische Versuche zur Fischer-Tropsch-Synthese im flüssigen Medium. In: Chemie Ingenieur Technik. Band 28, 1956, S. 381, doi:10.1002/cite.330280602.
- ↑ a b c Friedrich Asinger: Chemie und Technologie der Paraffin-Kohlenwasserstoffe. Akademie Verlag, 1956, S. 130–133.
- ↑ Maria Höring, Ernst E. Donath: Verflüssigung und Vergasung von Kohle. In: Die Naturwissenschaften. Band 61, 1974, S. 89–96, doi:10.1007/BF00606276.
- ↑ Arno de Klerk: American Hydrocol Facility. In: Arno de Klerk: Fischer‐Tropsch Refining. Wiley‐VCH Verlag, Weinheim 2011, ISBN 978-3-527-32605-1, S. 141–151.
- ↑ D. J. Duvenhage, T. Shingles: Synthol reactor technology development. In: Catalysis Today. 71.3–4, 2002, S. 301–305, doi:10.1016/s0920-5861(01)00456-4.
- ↑ a b Arno de Klerk: Fischer-Tropsch refining. University of Pretoria, Pretoria, South Africa (PhD thesis), 2008 (englisch), S. 99–102.
- ↑ P. L. Spath, D. C. Dayton: Preliminary Screening - Technical and Economic Assessment of Synthesis Gas to Fuels and Chemicals with Emphasis on the Potential for Biomass-Derived Syngas. ( vom 17. Dezember 2008 im Internet Archive) (PDF; 1,6 MB), NREL/TP510-34929, Dezember 2003, S. 95.
- ↑ Arno de Klerk: Fischer–Tropsch fuels refinery design. In: Energy & Environmental Science. 4.4, 2011, S. 1177–1205, doi:10.1039/c0ee00692k.
- ↑ Arno de Klerk: Fischer-Tropsch refining. University of Pretoria, Pretoria, South Africa (PhD thesis), 2008 (englisch), S. 122.
- ↑ C. Bouchy, G. Hastoy, E. Guillon, J. A. Martens: Fischer-Tropsch Waxes Upgrading via Hydrocracking and Selective Hydroisomerization. In: Oil & Gas Science and Technology. Band 64, 2009, S. 91–112, doi:10.2516/ogst/2008047.
- ↑ J. T. Kummer, T. W. DeWitt, P. H. Emmett: Some Mechanism Studies on the Fischer-Tropsch Synthesis Using 14C. In: Journal of the American Chemical Society. Band 70, 1948, S. 3632–3643, doi:10.1021/ja01191a029.
- ↑ Y. Zhang, L. Hou, J. W. Tierney, I. Wender: Acetylenes as probes in the Fischer–Tropsch Reaction. In: Topics in Catalysis. 32.3–4, 2005, S. 125–133, doi:10.1007/s11244-005-2884-7.
- ↑ R. A. van Santen u. a.: Mechanism and microkinetics of the Fischer–Tropsch reaction. In: Physical Chemistry Chemical Physics. Vol. 40, 2013, S. 17038, doi:10.1039/c3cp52506f.
- ↑ Ian C. Yates, Charles N. Satterfield: Intrinsic kinetics of the Fischer-Tropsch synthesis on a cobalt catalyst. In: Energy & Fuels. Band 5, 1991, S. 168–173, doi:10.1021/ef00025a029.
- ↑ Gerard P. van der Laan, A. A. C. M. Beenackers: Kinetics and Selectivity of the Fischer-Tropsch Synthesis: A Literature Review. In: Catalysis Reviews. Band 41, 1999, S. 255–318, doi:10.1081/CR-100101170.
- ↑ Gerard P. van der Laan, Antonie A.C.M. Beenackers: Intrinsic kinetics of the gas-solid Fischer-Tropsch and water gas shift reactions over a precipitated iron catalyst. In: Applied Catalysis A: General. Band 193, 2000, S. 39–53, doi:10.1016/S0926-860X(99)00412-3.
- ↑ W. Keith Hall, R. J. Kokes, P. H. Emmett: Mechanism Studies of the Fischer-Tropsch Synthesis: The Incorporation of Radioactive Ethylene, Propionaldehyde and Propanol. In: Journal of the American Chemical Society. Band 82, 1960, S. 1027–1037, doi:10.1021/ja01490a005.
- ↑ Hans Schulz: Short history and present trends of Fischer-Tropsch synthesis. In: Applied Catalysis A: General. Band 186, 1999, S. 3–12, doi:10.1016/S0926-860X(99)00160-X.
- ↑ a b R. A. van Santen, I. M. Ciobîc, E. van Steen, M. M. Ghouri: Mechanistic Issues in Fischer-Tropsch Catalysis. In: Bruce C. Gates, Helmut Knözinger: Advances in Catalysis. Vol. 54, Burlington Academic Press, 2011, ISBN 978-0-12-387772-7, S. 127–187.
- ↑ O. P. R. van Vliet, A. P. C. Faaij, W. C. Turkenburg: Fischer–Tropsch diesel production in a well-to-wheel perspective: A carbon, energy flow and cost analysis. In: Energy Conversion and Management. 50.4, 2009, S. 855–876, doi:10.1016/j.enconman.2009.01.008.
- ↑ T. W. Patzek, G. D. Croft: Potential for Coal-to-Liquids Conversion in the United States—Fischer–Tropsch Synthesis. In: Natural Resources Research. 18.3, 2009, S. 181–191, doi:10.1007/s11053-009-9098-9.
- ↑ S. Yang u. a.: Sustainability Assessment of the Coal/Biomass to Fischer–Tropsch Fuel Processes. In: ACS Sustainable Chemistry & Engineering. 2.1, 2013, S. 80–87, doi:10.1021/sc400336e.
- ↑ a b Anthony Andrews, Jeffrey Logan: Fischer-Tropsch Fuels from Coal, Natural Gas, and Biomass: Background and Policy. CRS Report for Congress, Order Code RL34133, Updated March 27, 2008.
- ↑ A. E. M. van den Oever, D. Costa, G. Cardellini, M. Messagie: Systematic review on the energy conversion efficiency of biomass-based Fischer-Tropsch plants. In: Fuel. Band 324, 2022, S. 124478, doi:10.1016/j.fuel.2022.124478.
- ↑ Sachverständigenrat für Umweltfragen: Sondergutachten Umsteuern erforderlich: Klimaschutz im Verkehrssektor. Berlin 2017, ISBN 978-3-947370-11-5, S. 86–87.























