„Nitrile“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K typo, form |
Vertreter, Verwendung von Cyanacrylaten. |
||
| Zeile 14: | Zeile 14: | ||
=== Spektroskopische Eigenschaften === |
=== Spektroskopische Eigenschaften === |
||
In der [[Infrarotspektroskopie|IR-Spektroskopie]] tritt durch die [[Valenzschwingung|Streckschwingung]] der C≡N-Dreifachbindung eine deutliche Bande bei etwa 2250 cm<sup>–1</sup> auf. Ist die Nitrilgruppe mit einer Alkendoppelbindung konugiert, tritt die Bande bei etwa 2225 cm<sup>–1</sup>. Ist die Nitrilgruppe an einen aromatischen Ring gebunden, liegt die Bande meist zwischen den beiden Werten.<ref>{{Literatur |Autor=Robert E. Kitson, Norman E. Griffith |Titel=Infrared Absorption Band Due to Nitrile Stretching Vibration |Sammelwerk=Analytical Chemistry |Band=24 |Nummer=2 |Datum=1952-02-18 |DOI=10.1021/ac60062a019 |Seiten=334–337}}</ref> Im [[Kernspinresonanzspektroskopie|<sup>1</sup>H-NMR]] treten Protonen, die α zur Nitrilgruppe stehen bei etwa 2 ppm (z. B. 1,98 ppm in Acetonitril) auf, also bei einer ähnlichen [[Chemische Verschiebung|Verschiebung]] wie Protonen, die α zu anderen Carbonsäurederivaten stehen (beispielsweise [[Carbonsäuren|Carbonsäure]] oder [[Carbonsäureamide|Carbonsäureamid]]). Das Kohlenstoff der Nitrilfunktion tritt im <sup>13</sup>C-NMR bei etwa 112–126 ppm auf.<ref name=":16" /> |
In der [[Infrarotspektroskopie|IR-Spektroskopie]] tritt durch die [[Valenzschwingung|Streckschwingung]] der C≡N-Dreifachbindung eine deutliche Bande bei etwa 2250 cm<sup>–1</sup> auf. Ist die Nitrilgruppe mit einer Alkendoppelbindung konugiert, tritt die Bande bei etwa 2225 cm<sup>–1</sup>. Ist die Nitrilgruppe an einen aromatischen Ring gebunden, liegt die Bande meist zwischen den beiden Werten.<ref>{{Literatur |Autor=Robert E. Kitson, Norman E. Griffith |Titel=Infrared Absorption Band Due to Nitrile Stretching Vibration |Sammelwerk=Analytical Chemistry |Band=24 |Nummer=2 |Datum=1952-02-18 |DOI=10.1021/ac60062a019 |Seiten=334–337}}</ref> Im [[Kernspinresonanzspektroskopie|<sup>1</sup>H-NMR]] treten Protonen, die α zur Nitrilgruppe stehen bei etwa 2 ppm (z. B. 1,98 ppm in Acetonitril) auf, also bei einer ähnlichen [[Chemische Verschiebung|Verschiebung]] wie Protonen, die α zu anderen Carbonsäurederivaten stehen (beispielsweise [[Carbonsäuren|Carbonsäure]] oder [[Carbonsäureamide|Carbonsäureamid]]). Das Kohlenstoff der Nitrilfunktion tritt im <sup>13</sup>C-NMR bei etwa 112–126 ppm auf.<ref name=":16" /> |
||
=== Vertreter === |
|||
Verschiedene einfache Nitrile sind in der folgenden Tabelle mit Schmelz- und Siedepunkten angegeben. Das einfachste Nitril ist das Acetonitril. Die Alkannitrile mit zwei bis vier Kohlenstoffatomen sind alle bei Raumtemperatur flüssig. Das gleiche gilt auch für das einfachste α,β-ungesättigte Nitril, Acrylnitril und das einfachste aromatische Nitril, Benzonitril. |
|||
{| class="wikitable" style="text-align:right;" |
|||
|+Lineare Alkine |
|||
!Summenformel |
|||
!Molmasse |
|||
!Name |
|||
!Strukturformel |
|||
!CAS-Nummer |
|||
!Schmelzpunkt |
|||
!Siedepunkt |
|||
|- |
|||
|C<sub>2</sub>H<sub>3</sub>N |
|||
|41,05 g/mol |
|||
|Acetonitril |
|||
|[[Datei:Acetonitril Strukturformel.svg|130x130px|Acetonitril]] |
|||
|75-05-8 |
|||
|−45 °C<ref name="GESTIS1">{{GESTIS|ZVG=13660|CAS=75-05-8|Name=Acetonitril|Abruf=2023-12-09}}</ref> |
|||
|82 °C<ref name="GESTIS1"/> |
|||
|- |
|||
|C<sub>3</sub>H<sub>5</sub>N |
|||
|55,08 g/mol |
|||
|Propionitril |
|||
|[[Datei:Structural formula of propionitrile.svg|150x150px|Propionitril]] |
|||
|107-12-0 |
|||
|−103 °C<ref name="GESTIS2">{{GESTIS|ZVG=013670|CAS=107-12-0|Name=Propionitril|Abruf=2023-12-09}}</ref> |
|||
|97°C<ref name="GESTIS2" /> |
|||
|- |
|||
|C<sub>4</sub>H<sub>7</sub>N |
|||
|69,11 g/mol |
|||
|Butyronitril |
|||
|[[Datei:Butyronitrile StructureV1.svg|150x150px|Butyronitril]] |
|||
|109-74-0 |
|||
|−112 °C<ref name="GESTIS3">{{GESTIS|ZVG=038640|CAS=107-12-0|Name=Butyronitril|Abruf=2023-12-09}}</ref> |
|||
|117 °C<ref name="GESTIS3" /> |
|||
|- |
|||
|C<sub>4</sub>H<sub>7</sub>N |
|||
|69,11 g/mol |
|||
|Isobutyronitril |
|||
|[[Datei:Isobutyronitrile_Structural_Formula_V1.svg|150x150px|Isobutyronitril]] |
|||
|78-82-0 |
|||
|−72 °C<ref name="GESTIS4">{{GESTIS|ZVG=510611|CAS=78-82-0|Name=Isobutyronitril|Abruf=2023-12-09}}</ref> |
|||
|104 °C<ref name="GESTIS4" /> |
|||
|- |
|||
|C<sub>3</sub>H<sub>3</sub>N |
|||
|53,06 g/mol |
|||
|Acrylnitril |
|||
|[[Datei:Acrylnitril Strukturformel.svg|150x150px|Acrylnitril]] |
|||
|107-13-1 |
|||
|−82 °C<ref name="GESTIS5">{{GESTIS|ZVG=011410|CAS=107-13-1|Name=Acrylnitril|Abruf=2023-12-09}}</ref> |
|||
|77 °C<ref name="GESTIS5" /> |
|||
|- |
|||
|C<sub>7</sub>H<sub>5</sub>N |
|||
|103,12 g/mol |
|||
|Benzonitril |
|||
|[[Datei:Benzonitrile structure.svg|150x150px|Benzonitril]] |
|||
|100-47-0 |
|||
|−13 °C<ref name="GESTIS6">{{GESTIS|ZVG=026150|CAS=100-47-0|Name=Benzonitril|Abruf=2023-12-09}}</ref> |
|||
|191 °C<ref name="GESTIS6" /> |
|||
|} |
|||
== Vorkommen == |
== Vorkommen == |
||
| Zeile 104: | Zeile 165: | ||
=== Sonstige Herstellungsverfahren === |
=== Sonstige Herstellungsverfahren === |
||
Durch die [[Carbocyanierung]] kann ein Nitril an eine Mehrfachbindung addiert werden, wobei ein weiteres Nitril erhalten wird. Beispielsweise können Arylnitrile unter Katalyse mit [[Dicyclooctadiennickel(0)]] und [[Trimethylphosphin]] an Alkine addiert werden, wodurch α,β-ungesättigte Nitrile erhalten werden. Mit gewissen Änderungen an den Reaktionsbedingungen, beispielsweise Verwendung eines anderen [[Phosphane|Phosphins]] oder Zusatz einer [[Lewis-Säure-Base-Konzept|Lewis-Säure]] wie Trimethylaluminium oder [[Triphenylboran]], können auch nichtaromatische Nitrile addiert werden, sowohl gesättigte als auch α,β-ungesättigte.<ref>{{Literatur |Autor=Yoshiaki Nakao, Tamejiro Hiyama |Titel=Nickel-catalyzed carbocyanation of alkynes |Sammelwerk=Pure and Applied Chemistry |Band=80 |Nummer=5 |Datum=2008-01-01 |DOI=10.1351/pac200880051097 |Seiten=1097–1107}}</ref> Es sind auch Carbocyanierungen bekannt, bei denen zwei Moleküle verbunden werden und zusätzlich eine Nitrilgruppe eingeführt wird. Dies funktioniert beispielsweise durch Einsatz von [[Hexabutyldistannan]] sowie von [[Tosylcyanid]] als Quelle der Cyanidgruppe.<ref>{{Literatur |Autor=Haitham Hassan, Vincent Pirenne, Maren Wissing, Chahinaz Khiar, Ashique Hussain, Frédéric Robert, Yannick Landais |Titel=Free‐Radical Carbocyanation of Olefins |Sammelwerk=Chemistry – A European Journal |Band=23 |Nummer=19 |Datum=2017-04-03 |DOI=10.1002/chem.201605946 |Seiten=4651–4658}}</ref> |
Durch die [[Carbocyanierung]] kann ein Nitril an eine Mehrfachbindung addiert werden, wobei ein weiteres Nitril erhalten wird. Beispielsweise können Arylnitrile unter Katalyse mit [[Dicyclooctadiennickel(0)]] und [[Trimethylphosphin]] an Alkine addiert werden, wodurch α,β-ungesättigte Nitrile erhalten werden. Mit gewissen Änderungen an den Reaktionsbedingungen, beispielsweise Verwendung eines anderen [[Phosphane|Phosphins]] oder Zusatz einer [[Lewis-Säure-Base-Konzept|Lewis-Säure]] wie Trimethylaluminium oder [[Triphenylboran]], können auch nichtaromatische Nitrile addiert werden, sowohl gesättigte als auch α,β-ungesättigte.<ref>{{Literatur |Autor=Yoshiaki Nakao, Tamejiro Hiyama |Titel=Nickel-catalyzed carbocyanation of alkynes |Sammelwerk=Pure and Applied Chemistry |Band=80 |Nummer=5 |Datum=2008-01-01 |DOI=10.1351/pac200880051097 |Seiten=1097–1107}}</ref> Es sind auch Carbocyanierungen bekannt, bei denen zwei Moleküle verbunden werden und zusätzlich eine Nitrilgruppe eingeführt wird. Dies funktioniert beispielsweise durch Einsatz von [[Hexabutyldistannan]], sowie von [[Tosylcyanid]] als Quelle der Cyanidgruppe.<ref>{{Literatur |Autor=Haitham Hassan, Vincent Pirenne, Maren Wissing, Chahinaz Khiar, Ashique Hussain, Frédéric Robert, Yannick Landais |Titel=Free‐Radical Carbocyanation of Olefins |Sammelwerk=Chemistry – A European Journal |Band=23 |Nummer=19 |Datum=2017-04-03 |DOI=10.1002/chem.201605946 |Seiten=4651–4658}}</ref> |
||
Carbonsäuren können durch Umsetzung mit [[Indium(III)-chlorid]] in Acetonitril bei 200 °C in die entsprechenden Nitrile überführt werden. Dabei wirkt Acetonitril sowohl als Lösungsmittel als auch als Quelle für Stickstoffatome und wird bei der Reaktion zu [[Essigsäure]] umgesetzt. Die Reaktion verläuft über mehrere [[Mumm-Umlagerungen]].<ref>{{Literatur |Autor=Laurent Vanoye, Ahmad Hammoud, Hélène Gérard, Alexandra Barnes, Régis Philippe, Pascal Fongarland, Claude de Bellefon, Alain Favre-Réguillon |Titel=Direct Synthesis of Nitriles from Carboxylic Acids Using Indium-Catalyzed Transnitrilation: Mechanistic and Kinetic Study |Sammelwerk=ACS Catalysis |Band=9 |Nummer=11 |Datum=2019-11-01 |DOI=10.1021/acscatal.9b02779 |Seiten=9705–9714}}</ref> |
Carbonsäuren können durch Umsetzung mit [[Indium(III)-chlorid]] in Acetonitril bei 200 °C in die entsprechenden Nitrile überführt werden. Dabei wirkt Acetonitril sowohl als Lösungsmittel als auch als Quelle für Stickstoffatome und wird bei der Reaktion zu [[Essigsäure]] umgesetzt. Die Reaktion verläuft über mehrere [[Mumm-Umlagerungen]].<ref>{{Literatur |Autor=Laurent Vanoye, Ahmad Hammoud, Hélène Gérard, Alexandra Barnes, Régis Philippe, Pascal Fongarland, Claude de Bellefon, Alain Favre-Réguillon |Titel=Direct Synthesis of Nitriles from Carboxylic Acids Using Indium-Catalyzed Transnitrilation: Mechanistic and Kinetic Study |Sammelwerk=ACS Catalysis |Band=9 |Nummer=11 |Datum=2019-11-01 |DOI=10.1021/acscatal.9b02779 |Seiten=9705–9714}}</ref> |
||
| Zeile 116: | Zeile 177: | ||
Die Herstellung von Arylnitrilen gelingt unter anderem durch die [[Sandmeyer-Reaktion]] von [[Diazoniumsalze|Aryldiazoniumsalzen]] mit [[Kupfer(I)-cyanid]])<ref>{{Literatur |Autor=Irina P. Beletskaya, Alexander S. Sigeev, Alexander S. Peregudov, Pavel V. Petrovskii |Titel=Catalytic Sandmeyer cyanation as a synthetic pathway to aryl nitriles |Sammelwerk=Journal of Organometallic Chemistry |Band=689 |Nummer=23 |Datum=2004-11 |DOI=10.1016/j.jorganchem.2004.07.019 |Seiten=3810–3812}}</ref> und durch die [[Rosenmund-von Braun-Reaktion]] (direkte Umsetzung eines Arylbromids mit Kupfer(I)-cyanid).<ref>{{Literatur |Autor=C. Frederick Koelsch |Titel=Some Applications of the Rosenmund-v. Braun Nitrile Synthesis |Sammelwerk=Journal of the American Chemical Society |Band=58 |Nummer=8 |Datum=1936-08 |DOI=10.1021/ja01299a004 |Seiten=1328–1330}}</ref> Umsetzung von [[Thiocyanat|Metallthiocyanaten]] mit aromatischen Carbonsäuren wird als [[Letts-Nitrilsynthese]] bezeichnet. Dafür kann beispielsweise [[Kaliumthiocyanat]] verwendet werden, aber [[Bleithiocyanat]] ergibt bessere Ergebnisse.<ref>{{Literatur |Autor=David T. Mowry |Titel=The Preparation of Nitriles. |Sammelwerk=Chemical Reviews |Band=42 |Nummer=2 |Datum=1948-04-01 |DOI=10.1021/cr60132a001 |Seiten=189–283}}</ref> |
Die Herstellung von Arylnitrilen gelingt unter anderem durch die [[Sandmeyer-Reaktion]] von [[Diazoniumsalze|Aryldiazoniumsalzen]] mit [[Kupfer(I)-cyanid]])<ref>{{Literatur |Autor=Irina P. Beletskaya, Alexander S. Sigeev, Alexander S. Peregudov, Pavel V. Petrovskii |Titel=Catalytic Sandmeyer cyanation as a synthetic pathway to aryl nitriles |Sammelwerk=Journal of Organometallic Chemistry |Band=689 |Nummer=23 |Datum=2004-11 |DOI=10.1016/j.jorganchem.2004.07.019 |Seiten=3810–3812}}</ref> und durch die [[Rosenmund-von Braun-Reaktion]] (direkte Umsetzung eines Arylbromids mit Kupfer(I)-cyanid).<ref>{{Literatur |Autor=C. Frederick Koelsch |Titel=Some Applications of the Rosenmund-v. Braun Nitrile Synthesis |Sammelwerk=Journal of the American Chemical Society |Band=58 |Nummer=8 |Datum=1936-08 |DOI=10.1021/ja01299a004 |Seiten=1328–1330}}</ref> Umsetzung von [[Thiocyanat|Metallthiocyanaten]] mit aromatischen Carbonsäuren wird als [[Letts-Nitrilsynthese]] bezeichnet. Dafür kann beispielsweise [[Kaliumthiocyanat]] verwendet werden, aber [[Bleithiocyanat]] ergibt bessere Ergebnisse.<ref>{{Literatur |Autor=David T. Mowry |Titel=The Preparation of Nitriles. |Sammelwerk=Chemical Reviews |Band=42 |Nummer=2 |Datum=1948-04-01 |DOI=10.1021/cr60132a001 |Seiten=189–283}}</ref> |
||
Aryliodide können unter Palladiumkatalyse mit Trimethylsilylcyanid zu aromatischen Nitrilen umgesetzt werden. Beispielsweise ergibt die Reaktion von [[Iodbenzol]] mit Trimethylsilylcyanid und [[Tetrakis(triphenylphosphin)palladium(0)]] als Produkt [[Benzonitril]].<ref>{{Literatur |Autor=Naoto Chatani, Terukiyo Hanafusa |Titel=Transition-metal-catalyzed reactions of trimethylsilyl cyanide. 4. Palladium-catalyzed cyanation of aryl halides by trimethylsilyl cyanide |Sammelwerk=The Journal of Organic Chemistry |Band=51 |Nummer=24 |Datum=1986-11 |DOI=10.1021/jo00374a041 |Seiten=4714–4716}}</ref> Auch die palladiumkatalysierte Cyanierung von Arylchloriden mit Kaliumcyanid<ref>{{Literatur |Autor=Mark Sundermeier, Alexander Zapf, Matthias Beller, Jürgen Sans |Titel=A new palladium catalyst system for the cyanation of aryl chlorides |Sammelwerk=Tetrahedron Letters |Band=42 |Nummer=38 |Datum=2001-09 |DOI=10.1016/S0040-4039(01)01390-9 |Seiten=6707–6710}}</ref> oder [[Kaliumhexacyanidoferrat(II)]]<ref>{{Literatur |Autor=Todd D. Senecal, Wei Shu, Stephen L. Buchwald |Titel=A General, Practical Palladium‐Catalyzed Cyanation of (Hetero)Aryl Chlorides and Bromides |Sammelwerk=Angewandte Chemie |Band=125 |Nummer=38 |Datum=2013-09-16 |DOI=10.1002/ange.201304188 |Seiten=10219–10223}}</ref> ist bekannt. [[Chinone]] können mit Trimethylsilylcyanid zu silylierten Cyanhydrinen umgesetzt werden und anschließend mit [[Phosphortribromid]] aromatisiert werden.<ref>{{Literatur |Autor=Florian Glöcklhofer, Markus Lunzer, Johannes Fröhlich |Titel=Facile Synthesis of Cyanoarenes from Quinones by Reductive Aromatization of Cyanohydrin Intermediates |Sammelwerk=Synlett |Band=26 |Nummer=07 |Datum=2015-04-01 |DOI=10.1055/s-0034-1380150 |Seiten=950–952}}</ref> Eine weitere mögliche Synthese von Arylnitrilen ist die Umsetzung von Arylgrignard-Verbindungen oder Aryllithium-Verbindungen mit [[Dimethylmalonitril]].<ref>{{Literatur |Autor=Jonathan T. Reeves, Christian A. Malapit, Frederic G. Buono, Kanwar P. Sidhu, Maurice A. Marsini, C. Avery Sader, Keith R. Fandrick, Carl A. Busacca, Chris H. Senanayake |Titel=Transnitrilation from Dimethylmalononitrile to Aryl Grignard and Lithium Reagents: A Practical Method for Aryl Nitrile Synthesis |Sammelwerk=Journal of the American Chemical Society |Band=137 |Nummer=29 |Datum=2015-07-29 |DOI=10.1021/jacs.5b06136 |Seiten=9481–9488}}</ref> |
Aryliodide können unter Palladiumkatalyse mit Trimethylsilylcyanid zu aromatischen Nitrilen umgesetzt werden. Beispielsweise ergibt die Reaktion von [[Iodbenzol]] mit Trimethylsilylcyanid und [[Tetrakis(triphenylphosphin)palladium(0)]] (Pd(PPh<sub>3</sub>)<sub>4</sub>) als Produkt [[Benzonitril]].<ref>{{Literatur |Autor=Naoto Chatani, Terukiyo Hanafusa |Titel=Transition-metal-catalyzed reactions of trimethylsilyl cyanide. 4. Palladium-catalyzed cyanation of aryl halides by trimethylsilyl cyanide |Sammelwerk=The Journal of Organic Chemistry |Band=51 |Nummer=24 |Datum=1986-11 |DOI=10.1021/jo00374a041 |Seiten=4714–4716}}</ref> Eine weitere Synthesemöglichkeit, die ebenfalls auf Palladiumkatalyse beruht (auch hierfür kann Pd(PPh<sub>3</sub>)<sub>4</sub> eingesetzt werden) ist die [[Decarbonylierung]] aromatischer Carbonsäurecyanide.<ref>{{Literatur |Autor=Shunichi Murahashi, Takeshi Naota, Nobuyuki Nakajima |Titel=Palladium-catalyzed decarbonylation of acyl cyanides |Sammelwerk=The Journal of Organic Chemistry |Band=51 |Nummer=6 |Datum=1986-03 |DOI=10.1021/jo00356a029 |Seiten=898–901}}</ref> Auch die palladiumkatalysierte Cyanierung von Arylchloriden mit Kaliumcyanid<ref>{{Literatur |Autor=Mark Sundermeier, Alexander Zapf, Matthias Beller, Jürgen Sans |Titel=A new palladium catalyst system for the cyanation of aryl chlorides |Sammelwerk=Tetrahedron Letters |Band=42 |Nummer=38 |Datum=2001-09 |DOI=10.1016/S0040-4039(01)01390-9 |Seiten=6707–6710}}</ref> oder [[Kaliumhexacyanidoferrat(II)]]<ref>{{Literatur |Autor=Todd D. Senecal, Wei Shu, Stephen L. Buchwald |Titel=A General, Practical Palladium‐Catalyzed Cyanation of (Hetero)Aryl Chlorides and Bromides |Sammelwerk=Angewandte Chemie |Band=125 |Nummer=38 |Datum=2013-09-16 |DOI=10.1002/ange.201304188 |Seiten=10219–10223}}</ref> ist bekannt. [[Chinone]] können mit Trimethylsilylcyanid zu silylierten Cyanhydrinen umgesetzt werden und anschließend mit [[Phosphortribromid]] aromatisiert werden.<ref>{{Literatur |Autor=Florian Glöcklhofer, Markus Lunzer, Johannes Fröhlich |Titel=Facile Synthesis of Cyanoarenes from Quinones by Reductive Aromatization of Cyanohydrin Intermediates |Sammelwerk=Synlett |Band=26 |Nummer=07 |Datum=2015-04-01 |DOI=10.1055/s-0034-1380150 |Seiten=950–952}}</ref> Eine weitere mögliche Synthese von Arylnitrilen ist die Umsetzung von Arylgrignard-Verbindungen oder Aryllithium-Verbindungen mit [[Dimethylmalonitril]].<ref>{{Literatur |Autor=Jonathan T. Reeves, Christian A. Malapit, Frederic G. Buono, Kanwar P. Sidhu, Maurice A. Marsini, C. Avery Sader, Keith R. Fandrick, Carl A. Busacca, Chris H. Senanayake |Titel=Transnitrilation from Dimethylmalononitrile to Aryl Grignard and Lithium Reagents: A Practical Method for Aryl Nitrile Synthesis |Sammelwerk=Journal of the American Chemical Society |Band=137 |Nummer=29 |Datum=2015-07-29 |DOI=10.1021/jacs.5b06136 |Seiten=9481–9488}}</ref> |
||
=== Herstellung von Cyanhydrinen === |
=== Herstellung von Cyanhydrinen === |
||
| Zeile 161: | Zeile 222: | ||
=== Weitere Reaktionen === |
=== Weitere Reaktionen === |
||
Die reduktive Decyanierung ermöglicht die Entfernung einer Nitrilgruppe, wenn diese beispielsweise wegen ihrer dirigierenden oder elektronenziehenden Eigenschaften verwendet wurde. Die klassische Methode zur reduktiven Decyanierung ist die Verwendung von elementaren [[Alkalimetalle]] |
Die reduktive Decyanierung ermöglicht die Entfernung einer Nitrilgruppe, wenn diese beispielsweise wegen ihrer dirigierenden oder elektronenziehenden Eigenschaften verwendet wurde. Die klassische Methode zur reduktiven Decyanierung ist die Verwendung von elementaren [[Alkalimetalle|Alkalimetallen]] mit einem Protonendonor, beispielsweise mit [[Natrium]] in Ammoniak oder [[Lithium]] in [[Ethylamin]].<ref name=":18" /> Ein weiteres Beispiel ist die Verwendung von Kalium auf Aluminiumoxid in Hexan.<ref>{{Literatur |Autor=Diego Savoia, Emilio Tagliavini, Claudio Trombini, Achille Umani-Ronchi |Titel=Potassium on alumina as a reagent for reductive decyanation of alkylnitriles |Sammelwerk=The Journal of Organic Chemistry |Band=45 |Nummer=16 |Datum=1980-08 |DOI=10.1021/jo01304a016 |Seiten=3227–3229}}</ref> Vor allem aromatische Nitrile können auch mti Übergangsmetallkatalysatoren defunktionialisiert werden, beispielsweise auf der Basis von Nickel oder Cobalt.<ref name=":18" /> |
||
Bei der [[Ritter-Reaktion]] wird ein Alken oder ein tertiärer Alkohol mit einem Nitril und Schwefelsäure umgesetzt, wodurch ein ''N''-Alkylamid gebildet wird, wobei das Alken oder der Alkohol den Substituenten am Stickstoff ergibt.<ref>{{Literatur |Autor=Ghodsi Mohammadi Ziarani, Fatemeh Soltani Hasankiadeh, Fatemeh Mohajer |Titel=Recent Applications of Ritter Reactions in Organic Syntheses |Sammelwerk=ChemistrySelect |Band=5 |Nummer=45 |Datum=2020-12-07 |DOI=10.1002/slct.202003470 |Seiten=14349–14379}}</ref> |
Bei der [[Ritter-Reaktion]] wird ein Alken oder ein tertiärer Alkohol mit einem Nitril und Schwefelsäure umgesetzt, wodurch ein ''N''-Alkylamid gebildet wird, wobei das Alken oder der Alkohol den Substituenten am Stickstoff ergibt.<ref>{{Literatur |Autor=Ghodsi Mohammadi Ziarani, Fatemeh Soltani Hasankiadeh, Fatemeh Mohajer |Titel=Recent Applications of Ritter Reactions in Organic Syntheses |Sammelwerk=ChemistrySelect |Band=5 |Nummer=45 |Datum=2020-12-07 |DOI=10.1002/slct.202003470 |Seiten=14349–14379}}</ref> |
||
| Zeile 187: | Zeile 248: | ||
=== Sonstige Verwendungen === |
=== Sonstige Verwendungen === |
||
Eine zweistellige Anzahl an Nitrilen wird als Duftstoffe für Kosmetika verwendet. Dazu gehören unter anderem [[Zimtsäurenitril]], [[Dodecannitril]] und [[Benzonitril]].<ref>{{Literatur |Autor=David R Bickers, Peter Calow, Helmut A Greim, Jon M Hanifin, Adrianne E Rogers, Jean-Hilaire Saurat, I Glenn Sipes, Robert L Smith, Hachiro Tagami |Titel=The safety assessment of fragrance materials |Sammelwerk=Regulatory Toxicology and Pharmacology |Band=37 |Nummer=2 |Datum=2003-04 |DOI=10.1016/S0273-2300(03)00003-5 |Seiten=218–273}}</ref><ref>{{Literatur |Autor=S.P. Bhatia, V.T. Politano, A.M. Api |Titel=Evaluation of genotoxicity of nitrile fragrance ingredients using in vitro and in vivo assays |Sammelwerk=Food and Chemical Toxicology |Band=59 |Datum=2013-09 |DOI=10.1016/j.fct.2013.04.040 |Seiten=784–792}}</ref> |
Eine zweistellige Anzahl an Nitrilen wird als Duftstoffe für Kosmetika verwendet. Dazu gehören unter anderem [[Zimtsäurenitril]], [[Dodecannitril]] und [[Benzonitril]].<ref>{{Literatur |Autor=David R Bickers, Peter Calow, Helmut A Greim, Jon M Hanifin, Adrianne E Rogers, Jean-Hilaire Saurat, I Glenn Sipes, Robert L Smith, Hachiro Tagami |Titel=The safety assessment of fragrance materials |Sammelwerk=Regulatory Toxicology and Pharmacology |Band=37 |Nummer=2 |Datum=2003-04 |DOI=10.1016/S0273-2300(03)00003-5 |Seiten=218–273}}</ref><ref>{{Literatur |Autor=S.P. Bhatia, V.T. Politano, A.M. Api |Titel=Evaluation of genotoxicity of nitrile fragrance ingredients using in vitro and in vivo assays |Sammelwerk=Food and Chemical Toxicology |Band=59 |Datum=2013-09 |DOI=10.1016/j.fct.2013.04.040 |Seiten=784–792}}</ref> |
||
[[Cyanacrylate]] werden als [[Sekundenkleber]] verwendet, da sie als Einkomponentenzubereitung schnell bei normalen Umgebungsbedingungen aushärten und viele Materialien kleben können. Die bei weitem meistgenutzte Verbindung in diesem Bereich ist [[2-Cyanacrylsäureethylester|Ethylcyanacrylat]], in geringerem Maße werden beispielsweise [[2-Cyanacrylsäuremethylester|Methylcyanacrylat]] und [[Allylcyanacrylat]] verwendet.<ref>{{Literatur |Autor=H. W. Coover, D. W. Dreifus, J. T. O’Connor |Titel=Cyanoacrylate Adhesives |Sammelwerk=Handbook of Adhesives |Verlag=Springer US |Ort=Boston, MA |Datum=1990 |ISBN=978-1-4612-8019-4 |DOI=10.1007/978-1-4613-0671-9_27 |Seiten=463–477}}</ref> Cyanacrylatkleber werden auch im medizinischen Bereich verwendet, um Wunden zu verkleben, anstatt sie zu nähen. Da Ester mit kurzkettigen Alkylresten (wie Methylcyanacrylat) aber oft Nebenwirkungen, insbesondere [[Entzündung|Entzündungen]], verursachen, werden hier andere Verbindungen verwendet als im technischen Bereich. So kommen vor allem [[Butylcyanacrylat]] und [[Octylcyanacrylat]] zum Einsatz.<ref>{{Literatur |Autor=David García Cerdá, Antonio Martín Ballester, Alicia Aliena-Valero, Anna Carabén-Redaño, José M. Lloris |Titel=Use of cyanoacrylate adhesives in general surgery |Sammelwerk=Surgery Today |Band=45 |Nummer=8 |Datum=2015-08 |DOI=10.1007/s00595-014-1056-4 |Seiten=939–956}}</ref> |
|||
Nitrile finden Verwendung als [[Elektrolyt]]zusatzmittel in [[Lithiumbatterie]]n. So bewirkt beispielsweise der Zusatz von [[1,3,6-Hexantricarbonitril]] eine signifikante Zunahme der Leistung gegenüber einer entsprechenden Batterie ohne Zusatz. Die Wirkweise der Nitrilzusätze ist noch nicht vollständig geklärt.<ref>{{Internetquelle |url=https://www.chemie.de/news/1177889/wie-ein-gewoehnlicher-zusatzstoff-lithium-ionen-batterien-einen-schub-verleiht.html?xing_share=news |titel=Wie ein gewöhnlicher Zusatzstoff Lithium-Ionen-Batterien einen Schub verleiht |werk= |hrsg=Chemie.de |datum=2022-09-28 |abruf=2022-09-29 }}</ref><ref>{{Literatur |Autor=Chao Tang, Yawei Chen, Zhengfeng Zhang, Wenqiang Li, Junhua Jian, Yulin Jie, Fanyang Huang, Yehu Han, Wanxia Li, Fuping Ai, Ruiguo Cao, Pengfei Yan, Yuhao Lu, Shuhong Jiao |Titel=Stable cycling of practical high-voltage LiCoO2 pouch cell via electrolyte modification |Sammelwerk=[[Nano Research]] |Datum=2022 |DOI=10.1007/s12274-022-4955-5}}</ref> |
Nitrile finden Verwendung als [[Elektrolyt]]zusatzmittel in [[Lithiumbatterie]]n. So bewirkt beispielsweise der Zusatz von [[1,3,6-Hexantricarbonitril]] eine signifikante Zunahme der Leistung gegenüber einer entsprechenden Batterie ohne Zusatz. Die Wirkweise der Nitrilzusätze ist noch nicht vollständig geklärt.<ref>{{Internetquelle |url=https://www.chemie.de/news/1177889/wie-ein-gewoehnlicher-zusatzstoff-lithium-ionen-batterien-einen-schub-verleiht.html?xing_share=news |titel=Wie ein gewöhnlicher Zusatzstoff Lithium-Ionen-Batterien einen Schub verleiht |werk= |hrsg=Chemie.de |datum=2022-09-28 |abruf=2022-09-29 }}</ref><ref>{{Literatur |Autor=Chao Tang, Yawei Chen, Zhengfeng Zhang, Wenqiang Li, Junhua Jian, Yulin Jie, Fanyang Huang, Yehu Han, Wanxia Li, Fuping Ai, Ruiguo Cao, Pengfei Yan, Yuhao Lu, Shuhong Jiao |Titel=Stable cycling of practical high-voltage LiCoO2 pouch cell via electrolyte modification |Sammelwerk=[[Nano Research]] |Datum=2022 |DOI=10.1007/s12274-022-4955-5}}</ref> |
||
Version vom 29. Dezember 2023, 19:29 Uhr

Nitrile sind eine Gruppe chemischer Verbindungen mit der allgemeinen Formel R–C≡N. Die funktionelle Gruppe aus Kohlenstoff und dreifach gebundenem Stickstoff wird als Nitril- oder Cyanogruppe bezeichnet. Die Nitrile leiten sich formal von der Blausäure (HCN) durch Austausch des Wasserstoffatoms gegen einen organischen Rest ab. Die Isomere mit der Formel R–N≡C nennt man Isonitrile.
Geschichte
Nitrile waren bereits im 19. Jahrhundert bekannt. Beispielsweise stellten Friedrich Wöhler und Justus von Liebig schon 1832 Benzonitril her, indem sie Benzamid mit Bariumoxid dehydratisierten.[1] 1903 untersuchte Arthur Lapworth die Bildung von Cyanhydrinen durch Addition von Blausäure an Aldehyde und Ketone und entdeckte, dass das eigentliche Nucleophil das Cyanid-Ion ist, sodass Zusatz einer Base die Reaktionsgeschwindigkeit erhöht. Dabei handelte es sich um eine der ersten Untersuchungen eines organischen Reaktionsmechanismus.[2][3]
Vertreter und Eigenschaften
Beide Atome der Nitrilgruppe sind sp-hybridisiert. Die Struktur der Nitrilgruppe ähnelt der C≡C-Dreifachbindung in Alkinen.[4]
Acidität
Durch die stark elektronenziehenden Eigenschaften der Nitrilgruppe weisen die Verbindungen eine relevante CH-Acidität auf, können also in α-Position (am Kohlenstoffatom neben der Nitrilgruppe) vergleichsweise leicht deprotoniert werden.[5] Beispielsweise hat Malonitril mit zwei Nitrilgruppen einen pKs-Wert von etwa 11.[6] Cyanoform mit drei Nitrilgruppen gehört mit einem pKs-Wert von –5,1 zu den stärksten organischen Säuren überhaupt[7] und ist beispielsweise saurer als Schwefelsäure (pKs-Wert –3,0) oder Salpetersäure (pKs-Wert –1,5).[8] Weitere Beispiele für Nitrile mit sehr niedrigem pKs-Wert sind die Cyanoderivate von Cyclopentadien, beispielsweise hat Pentacyanocyclopentadien einen geschätzen pKs-Wert von –11.[9]
Spektroskopische Eigenschaften
In der IR-Spektroskopie tritt durch die Streckschwingung der C≡N-Dreifachbindung eine deutliche Bande bei etwa 2250 cm–1 auf. Ist die Nitrilgruppe mit einer Alkendoppelbindung konugiert, tritt die Bande bei etwa 2225 cm–1. Ist die Nitrilgruppe an einen aromatischen Ring gebunden, liegt die Bande meist zwischen den beiden Werten.[10] Im 1H-NMR treten Protonen, die α zur Nitrilgruppe stehen bei etwa 2 ppm (z. B. 1,98 ppm in Acetonitril) auf, also bei einer ähnlichen Verschiebung wie Protonen, die α zu anderen Carbonsäurederivaten stehen (beispielsweise Carbonsäure oder Carbonsäureamid). Das Kohlenstoff der Nitrilfunktion tritt im 13C-NMR bei etwa 112–126 ppm auf.[4]
Vertreter
Verschiedene einfache Nitrile sind in der folgenden Tabelle mit Schmelz- und Siedepunkten angegeben. Das einfachste Nitril ist das Acetonitril. Die Alkannitrile mit zwei bis vier Kohlenstoffatomen sind alle bei Raumtemperatur flüssig. Das gleiche gilt auch für das einfachste α,β-ungesättigte Nitril, Acrylnitril und das einfachste aromatische Nitril, Benzonitril.
| Summenformel | Molmasse | Name | Strukturformel | CAS-Nummer | Schmelzpunkt | Siedepunkt |
|---|---|---|---|---|---|---|
| C2H3N | 41,05 g/mol | Acetonitril | 75-05-8 | −45 °C[11] | 82 °C[11] | |
| C3H5N | 55,08 g/mol | Propionitril | 
|
107-12-0 | −103 °C[12] | 97°C[12] |
| C4H7N | 69,11 g/mol | Butyronitril | 
|
109-74-0 | −112 °C[13] | 117 °C[13] |
| C4H7N | 69,11 g/mol | Isobutyronitril | 
|
78-82-0 | −72 °C[14] | 104 °C[14] |
| C3H3N | 53,06 g/mol | Acrylnitril | 107-13-1 | −82 °C[15] | 77 °C[15] | |
| C7H5N | 103,12 g/mol | Benzonitril | 
|
100-47-0 | −13 °C[16] | 191 °C[16] |
Vorkommen
Schon in den 90er-Jahren waren über 100 natürlich vorkommende Nitrile bekannt,[17] inzwischen sind schon mehrere hundert bekannt.[18] Die Verbindungen kommen in Bakterien, Pilzen, Pflanzen, sowie Gliederfüßlern und Schwämmen vor.[17][18] Die Biosynthese natürlich vorkommender Nitrile geht oft von Aminosäuren aus. Deren N-Hydroxylierung und Decarboxylierung (Abspaltung der Carbonsäuregruppe als Kohlendioxid) ergibt Aldoxime, die die direkten Vorläufer der Nitrile sind.[17]
Vorkommen in Pflanzen
Viele Nitrile kommen als Sekundärmetaboliten in Pflanzen vor.
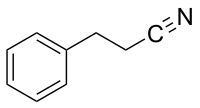
Im Wunderbaum (Ricinus communis) kommt neben dem hochgiftigen Protein Ricin auch das Alkaloid Ricinin vor, das eine Nitrilfunktion trägt.[19] Das strukturell eng verwandte Nudiflorin kommt in Trevia nudiflora (Familie Wolfsmilchgewächse) vor.[20] In braunem Senf kommt Indolacetonitril vor, das aus Indolacetaldoxim gebildet wird und vermutlich zur Verteidigung gegen pathogene Pilze dient.[21] In Jojoba kommt Simmondsin vor, ein Glycosid mit einem α,β-ungesättigten Nitril im Aglycon, sowie diverse verwandte Verbindungen.[22] Eine ähnliche Verbindung, das Menisdaurin, kommt in der Gewöhnlichen Stechpalme (Ilex aquifolium) vor.[23] Auch in mehreren Arten der Gattung Acacia kommen α,β-ungesättigte Nitrile vor, darunter das Sutherlandin und das Acacipetalin.[24][25] Im Meerrettichbaum (Moringa oleifera) kommt Niazirin vor, ein Glycosid von 4-Hydroxyphenylacetonitril.[26] Die Duftende Platterbse (Lathyrus odoratus) verursacht die Krankheit Lathyrismus, wofür N-Glutamyl-3-aminopropionitril und sein Abbauprodukt 3-Aminopropionitril verantwortlich sind.[27][28] Das ätherische Öl von Heracleum transcaucasicum (Gattung Bärenklau) enthält Geranylnitril.[29] Pyridin-3-carbonitril kommt im Einjährigen Bingelkraut vor.[30] Cyanolipide sind eine Klasse von Lipiden, die ausschließlich in Seifenbaumgewächsen (Sapindaceae) vorkommen. Die Alkoholkomponente ist bei diesen ein ungesättigten Nitril mit fünf Kohlenstoffatomen und ein oder zwei Hydroxygruppen, im Gegensatz zum Glycerin in den Glyceriden. Zu den Seifenbaumgewächsen, die Cyanolipide enthalten, gehören zum Beispiel Waschnussbaum und Guaraná.[31][32]
-
Ricinuspflanze
-
Struktur des Ricinins
-
Guaraná, ein Seifenbaumgewächs, enthält Cyanolipide
-
Eine Alkoholkomponente von Cyanolipiden, die z. B. in Guaraná vorkommt
Nitrile aus Glucosinolaten in Kreuzblütlern
Eine Gruppe von Naturstoffen, die als Vorläufer von Nitrilen auftreten, sind die Glucosinolate (Senfölglycoside), die ähnlich wie bei der direkten Biosynthese von Nitrilen über ein Aldoxim gebildet werden.[17] Die Glucosinolate sind eine wichtige Gruppe von Sekundärmetaboliten, die Pflanzen der Familie der Kreuzblütler (Brassicaceae) zur Verteidigung gegen Fressfeinde und Mikroorganismen dienen. Glucosinolate werden durch Myrosinase im Normalfall zu Isothiocyanaten abgebaut; in Gegenwart eines zusätzlichen Proteins (epithio specifier protein) jedoch unter anderem zu Nitrilen.[33][34] Beispielsweise kommt Sinigrin vor allem in Meerrettich, Wasabi und braunem Senf vor, aber auch in Kopfkohl, Grünkohl, Blumenkohl und Rosenkohl, und wird neben Allylisothiocyanat unter anderem zu 3-Butennitril abgebaut.[35][36] Glucotropaeolin, das in Gartenkresse vorkommt, wird unter anderem zu Phenylacetonitril abgebaut, Gluconasturtiin, das in Brunnenkresse vorkommt, unter anderem zu Phenylpropionitril.[37] Sinalbin, das beispielsweise in Pfeilkresse vorkommt, kann analog zu 4-Hydroxyphenylacetonitril abgebaut werden.[38]
-
Brunnenkresse
-
Struktur des Gluconasturtiins
-
Struktur des Phenylpropionitrils
Cyanhydrine und cyanogene Glycoside
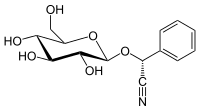
Cyanhydrine und deren Glycoside, die als cyanogene Glycoside bezeichnet werden, sind in der Natur weitverbreitet und kommen in mehreren tausend Pflanzenarten vor.[3][18] Über einhundert verschiedene natürlich vorkommende cyanogene Glycoside sind bekannt.[18] Cyanogene Glycoside dienen Pflanzen zur Verteidigung, aber möglicherweise auch als Speicherform für Stickstoff. Sie werden ausgehend von einer kleinen Zahl verschiedener Aminosäuren und diversen Zuckern gebildet.[3] Bei Beschädigung der Pflanze kommen die Glycoside mit Enzymen (β-Glucosidasen und α-Hydroxynitrillyasen) in Kontakt, die zuerst das Aglycon (ein Cyanhydrin) freisetzen und dieses dann zu einer Carbonylverbindung und giftiger Blausäure abbauen. Amygdalin ist ein Glycosid des Mandelonitrils und ist eines der am weitesten verbreiteten cyanogenen Glycoside und kommt insbesondere in den Samen der Rosengewächse (Rosaceae) vor, darunter beispielsweise Apfel, Aprikose, Pfirsich, Pflaume, Kirsche und Mandel.[39] Während Amygdalin nur in Kernen von Pfirsichen vorkommt, enthalten die sonstigen Teile der Pflanze vorwiegend Prunasin.[40] Prunasin ist ebenfalls ein Glycosid des Mandelonitrils, allerdings ist die Zuckereinheit ein Monosaccharid (kein Disaccharid wie bei Amygdalin). Prunasin kommt als biosynthetischer Vorläufer von Amygdalin vor, beispielsweise in Mandeln und Bittermandeln.[41] Prunasin kommt außerdem beispielsweise in Kirschlorbeer vor.[42] In Passionsfrüchten kommen Prunasin und Sambunigrin, sowie einige andere cyanogene Glycoside vor; in Papaya vor allem Prunasin.[43][44] Sambunigrin, ebenfalls ein Glycosid von Mandelonitril, kommt auch in mehreren Arten der Gattung Holunder (Sambucus) vor, unter anderem im Schwarzen Holunder und im Kanadischen Holunder,[45][46] sowie in Ximenia americana.[47] Vicianin, ein weiteres Glycosid des Mandelonitrils, kommt in verschiedenen Farnen der Gattung Davellia (Familie Davelliaceae) vor.[48] Dhurrin ist ein cyanogenes Glycosid des 4-Hydroxymandelonitrils, das in Sorghumhirse und anderen Arten der Gattung Sorghum vorkommt, beispielsweise in Sorghum halepense.[49][50] Linamarin (mit dem Aglycon Acetoncyanhydrin) und Lotaustralin (mit dem Agylcon Butanoncyanhydrin) treten im Allgemeinen gemeinsam auf, beispielsweise in den Gattungen Linum (z. B. in Flachs) und Lotus, sowie in der Gartenbohne.[51] Auch in Maniok kommen beide Verbindungen vor.[52] In der Mistelart Loranthus micranthus (Gattung Loranthus) kommt Linamaringallat vor, also ein Derivat bei dem Linamarin zusätzlich mit Gallussäure verestert ist.[53] Der Kautschukbaum enthält ebenfalls Linamarin und Studien haben ergeben, dass die Verbindung in diesem Fall wahrscheinlich auch eine wichtige Speichersubstanz ist und nicht nur der Verteidigung dient. Die Samen enthalten besonders große Mengen der Verbindung, die bei der Entwicklung der Keimlinge umgewandelt wird, ohne dass Blausäure freigesetzt wird, was darauf hindeutet, dass das Linamarin für andere biosynthetische Prozesse verwendet wird.[54]
-
Pfirsichbaum
-
Struktur des Amygdalins
-
Struktur des Prunasins
-
Mandelonitril, das Aglycon von Amygdalin und Prunasin
Vorkommen in Tieren
In vielen Gliederfüßlern (Arthropoda) kommen cyanogene (Blausäure freisetzende) Nitrilverbindungen vor, unter anderem in Hundertfüßern (Chilopoda), Doppelfüßern (Diplopoda), Schnabelkerfe (Hemiptera), Käfern (Coleoptera) und Schmetterlingen (Lepidoptera).[55] Im Stachelbeerspanner (Abraxas grossulariata) kommt ein nitrilhaltiges Glycosid, Sarmentosin, vor, das vermutlich der Verteidigung dient.[56] Sarmentosin kommt außerdem in mehreren Arten der Gattung Parnassius vor.[57] Mehrere Arten der Glasflügelwanzen (Jadera haematoloma, Jadera sanguinolenta und Leptocoris isolata) enthalten Cyanolipide beziehungsweise Cardiospermin, die sie möglicherweise aus ihren Nahrungspflanzen sequestrieren, also aufnehmen und einlagern.[55][58][59] Sechsfleck-Widderchen sind Schmetterlinge, die die cyanogenen Glycoside Linamarin und Lotaustralin sowoh aus ihren Nahrungspflanzen sequestrieren als auch selbst synthetisieren können.[60] Auch andere Arten aus der gleichen Gattung (Zygaena), zum Beispiel das Sumpfhornklee-Widderchen, enthalten cyanogene Glycoside.[61] Das Wehrsekret des Hundertfüßers Himantarium gabrielis enthält Benzoylcyanid, Phenylacetonitril, Mandelonitril (Benzaldehydcyanhydrin) und Mandelonitrilbenzoat.[62] Phenylacetonitril kommt auch als Hormon bei der Wüstenheuschrecke (Schistocerca gregaria) vor.[63] Bei verschiedenen Bandfüßern enthält das Wehrsekret ebenfalls Benzoylcyanid.[64] In der Milbenart Oribatula tibialis (Ordnung Hornmilben, Oribatida) kommt Mandelonitrilhexanoat vor.[65]
-
Stachelbeerspanner
-
Wüstenheuschrecke
-
Himantarium gabrielis
-
Benzoylcyanid kommt in den Wehrsekreten verschiedener Arthropoda vor
Neben den Arthropoda enthalten auch verschiedene Meerestiere Nitrilverbindungen. Dazu gehören beispielsweise das Bursatellin aus Seehasen der Gattung Bursatella[66] und die aus Schwämmen isolierten Calyculine.[67] Bei den Albanitrilen aus Schwämmen der Gattung Mycale handelt es sich um lineare Verbindungen (Kettenlänge 16 bis 18), die an einem oder beiden Enden eine Nitrilfunktion und zusätzlich mehrere C≡C-Dreifachbindungen aufweisen.[68]
Vorkommen in Pilzen
Die Epurpurine sind eine Gruppe gelber Phenolfarbstoffe, die jeweils zwei Nitrilgruppen tragen und in Emericella purpurea vorkommen.[69] Diatretin II kommt im Fleischfalben Trichterling (Clitocybe diatreta)[70] und dem violetten Rötelritterling vor.[71] Im Nelken-Schwindling kommt Glyoxalsäure-Cyanhydrin vor, das aus zwei Molekülen Glycin gebildet wird und bei Beschädigung des Pilzes Blausäure freisetzt.[72]
Vorkommen in Bakterien
Aus Pseudomonas veronii wurden diverse Alkannitrile isoliert: Dodecannitril, Tridecannitril, Tetradecannitril, Pentadecannitril und Hexadecannitril, außerdem einige Verbindungen mit ähnlicher Kettenlänge, die aber eine Doppelbindung aufweisen. Aus Micromonospora echinospora wurden ebenfalls einige Verbindungen mit ähnlicher Kettenlänge isoliert, die aber eine Methylverzweigung am Kettenende, eine Doppelbindung, oder beides aufweisen.[73] Aus Streptomyces regensis ist ein Cyanhydrin bekannt, das zusätzlich eine Phosphonsäuregruppe aufweist.[74] Das Aethokthonotoxin aus dem Cyanobakterium Aetokthonos hydrillicola ist ein bromiertes Indolderivat, das zuätzlich eine Nitrilgruppe trägt. Es ist ein Neurotoxin, das oft zum Tod von Weißkopfseeadlern führt, die es über die Nahrung aufnehmen.[75]
Vorkommen im Weltall
Nitrile gehören zu den häufigsten organischen Molekülen im Weltall und mehr als zehn Verbindungen wurden eindeutig nachgewiesen. Dazu gehören beispielsweise Acetonitril und Aminoacetonitril,[76] sowie Isobutyronitril,[77] Cyanoacetylen und diverse Cyanopolyine mit zwei bis fünf konjugierten Dreifachbindungen.[78]
Bedeutung für die Entstehung des Lebens
Nitrile spielten möglicherweise eine wichtige Rolle bei der Entstehung des Lebens auf der Erde.[79][80] Insbesondere sind Aminonitrile wahrscheinliche Vorläufer der Aminosäuren und Peptide, z. B. Aminoacetonitril von Glycin. Hierbei wird ein Prozess analog zur Strecker-Synthese vermutet, sodass sich beispielsweise zunächst aus Cyanid, Acetaldehyd und Ammoniak das α-Aminopropionitril bilden kann, das anschließend zu Alanin hydrolysiert wird.[79][81][82] Außerdem werden Blausäure und Nitrile wie Cyanoacetylen und Dicyan als Vorläufer der Nukleinbasen vermutet.[80]
Nomenklatur

nach IUPAC: Butannitril (blau markiertes C-Atom zählt zur Hauptkette),
formal auch Propancarbonitril (blau markiertes C-Atom zählt zum Substituenten)
Die funktionelle Gruppe der Nitrile mit der C≡N-Dreifachbindung wird als Nitril- oder Cyanogruppe bezeichnet.[83] Ist das Nitril die funktionelle Gruppe höchster Rangordnung, so wird die Endung „-nitril“ an den Namen der Ausgangsverbindung angehängt, die Benennung erfolgt als „Alkannitril“. Das dreifach gebundene Kohlenstoffatom wird, wie immer, für die Benennung des Grundgerüsts mitgezählt.[84] Alternativ kann (analog zu -carbonsäure), die Endung „-carbonitril“ verwendet werden, hier wird das Kohlenstoffatom nicht zum Grundgerüst gezählt.[85] Entsprechend ihrer Verwandtschaft mit den Carbonsäuren (der Nitrilkohlenstoff hat die gleiche Oxidationsstufe wie der Carboxylkohlenstoff) werden Trivialnamen oft aus dem Namen der Carbonsäuren mit der Endung „-onitril“ abgeleitet (z. B. Bezoesäure zu Benzonitril).[4]
Ist die Nitrilfunktion nicht von höchster Rangordnung im Molekül, so wird die Vorsilbe „Cyan-“ mit entsprechender Positionsbezeichnung verwendet. Auch hier wird das dreifach gebundene Kohlenstoffatom nicht zum Grundgerüst gezählt.
Herstellung
Für die Herstellung von Nitrilen existiert eine große Anzahl an Methoden. Dazu gehören die Kolbe-Nitril-Synthese, die Dehydratisierung von Carbonsäureamiden und Aldoximen und die Oxidation primärer Amine.
Additions- und Subtitutionsreaktionen mit Cyanidgruppen
Ein mögliches Herstellungsverfahren für Nitrile ist die Kolbe-Nitrilsynthese. Dabei entsteht in einer Substitutionsreaktion aus einem Alkylhalogenid und einem Alkalicyanid (Natriumcyanid oder Kaliumcyanid) das Alkannitril und ein Alkalihalogenid. Die Reaktion eignet sich besonders gut zur Umsetzung primärer sowie allylischer und benzylischer Halogenide. Sekundäre Alkylhalogenide liefern schlechtere Ausbeuten, tertiäre reagieren nur durch Eliminierung. Neben Halogeniden können auch andere Edukte mit anderen guten Abgangsgruppen verwendet werden. Silbercyanid ist im Gegensatz zu Alkalicyaniden nicht als Resgenz geeignet, da mit diesem vorzugsweise Isonitrile gebildet werden.[86] Ein Beispiel für eine solche Umsetzung ist die Reaktion von Methyliodid mit Natriumcyanid zu Acetonitril und Natriumiodid:[87]
Analog kann beispielsweise 1,3-Dibrompropan mit Natriumcyanid zu Pentandinitril umgesetzt werden[88] oder 1-Iodoctan mit Kaliumcyanid zu Nonannitril.[89] Mit Blausäure / Triethylaluminium oder mit Diethylaluminiumcyanid können ebenfalls Cyanierungen durchgeführt werden, beispielsweise die Ringöffnung eines Epoxids zu einem β-Cyanhydrin oder die 1,4-Addition von Cyanid an ein Enon.[90][91] Trimethylsilylcyanid ist ein weiteres Cyanierungsreagenz mit dem Epoxide zu β-Cyanhydrinen geöffnet werden können. Dabei wird das Sauerstoffatom silyliert.[92] Mit Trimethylsilylcyanid gelingt außerdem die Substitution tertiärer Alkylhalogenide, die mit der Kolbe-Nitril-Synthese nicht möglich ist.[86]
Dehydratisierungsreaktionen
Carbonsäureamide und Aldoxime können durch Dehydratisierung (Abspaltung eines Wassermoleküls) zu Nitrilen umgesetzt werden, wofür eine große Zahl an Reagenzien und Methoden bekannt ist.[1][93][94] Auch für die Herstellung von Nitrilen durch die Dehydratisierung von Nitroalkanen sind Methoden bekannt.[95]
Ein Reagenz für die Dehydratisierung von Carbonsäureamiden, das schon Mitte des 19. Jahrhunderts bekannt war, ist Phosphorpentoxid.[1] Amide können außerdem durch Umsetzung mit verschiedenen dreiwertigen Phosphorreagenzien wie Phosphortrichlorid oder Triphenylphosphit dehydratisiert werden;[94] sowie mit Diethylchlorphosphat[96] oder Thionylchlorid.[97] Bei Einsatz eines geeigneten Katalysators (z. B. bestimmte Palladium-Komplexe) kann Acetonitril als Dehydratisierungsreagenz wirken, um ein Amid in ein Nitril zu überführen, wobei es selbst zu Acetamid reagiert. Analog kann auch Dichloracetonitril verwendet werden.[98][99] Ähnliche Methoden verwenden Eisen(II)-chlorid-Tetrahydrat, Zinktriflat oder Uranylnitrat-Hexahydrat als Katalysator und N-Methyl-N-trimethylsilyltrifluoracetamid als Dehydratisierungsreagenz.[100][101][102] Auch mittels eines Reaktionssystems aus Triphenylphosphin, Iod und N-Methylmorpholin können Carbonsäureamide dehydriert werden.[103] Eine weitere Methode stellt die Dehydratisierung bei hohen Temperaturen (220–240 °C) in Hexamethylphosphorsäuretrisamid (HMPT) dar.[104]
Sowohl Carbonsäureamide als auch Aldoxime können durch Umsetzung mit Aluminiumchlorid und Natriumiodid in Acetonitril dehydratisiert werden.[93] Ebenso können beide Verbindungsklassen mit Oxalylchlorid und katalytisch Dimethylsulfoxid dehydratisiert werden, in einer Reaktion, die ähnlich einer Swern-Oxidation abläuft.[105] Auch die Umsetzung zu Nitrilen unter Katalyse mit siebenwertigem Rhenium (z. B. Perrheniumsäure oder Trimethylsilylperrhenat) gelingt sowohl mit Amiden als auch mit Aldoximen. Als Nebenprodukt anfallendes Wasser kann durch azeotrope Destillation entfernt werden.[106]
Aldoxime können außerdem mit Cyanurchlorid dehydratisiert werden,[107] mit dem Burgess-Reagenz,[108] sowie mit einer Kombination von Trifluormethansulfonsäureanhydrid und Triphenylphosphin, wobei letzteres zu Triphenylphosphinoxid oxidiert wird.[109] Auch eine katalytische Dehydrierung ist möglich, beispielsweise mit Eisen(III)-triflat,[110] mit Kupfer(II)-acetat,[111] mit einem gemischten Hydroxid von Zinn und Wolfram[112] oder mit einem bimetallischen Palladium-Mangan-Katalysator.[113] Schließlich ist auch die enzymatische Dehydratisierung von Aldoximen mit Aldoxim-Dehydratasen möglich. Dabei handelt es ich um Enzyme, die in verschiedenen Bakterien vorkommen, beispielsweise in Pseudomonas chlororaphis, und die schon verschiedentlich zur Synthese von Nitrilen verwendet wurden.[114]
Herstellung aus Aldehyden und Ketonen
Aldehyde können mit Hydroxylaminhydrochlorid in Oxime überführt werden und dann weiter zu Nitrilen dehydratisiert werden (beispielsweise mit Oxalylchlorid).[115] Auch direkte Umsetzungen von Aldehyden zu Nitrilen sind bekannt, beispielsweise mittel Hydroxylamin-O-sulfonsäure[116] oder O-(4-Trifluormethylbenzoyl)hydroxylamin.[117] Eine solche Umsetzung ist auch mit Hydroxylamin möglich, wenn Titan(IV)-chlorid oder ein gemischtes Hydroxid von Zinn und Wolfram oder als Katalysator verwendet wird[112][118] oder wenn Sulfurylfluorid oder Selenoxid als zusätzliches Reagenz verwendet wird.[119][120] Tosylmethylisocyanid (auch Van-Leusen-Reagenz genannt) ermöglicht die direkte Umwandlung eines Ketons in ein Nitril, was als Van-Leusen-Reaktion bezeichnet wird. Dabei wird die gesamte Nitrilgruppe und damit auch ein zusätzliches Kohlenstoffatom eingeführt.[121][122][123]
Herstellung aus Aminen
Primäre Amine (R-CH2-NH2) können mittels verschiedener Methoden zu Nitrilen oxidiert werden. Beispielsweise sind mehrere Verfahren bekannt, die Nitroxylradikale wie TEMPO und dessen Derivat 4-Acetamido-TEMPO als katalytisches Oxidationsmittel verwenden. Diese können beispielsweise durch Oxone als stöchiometrisches Oxidationsmittel regeneriert werden oder elektrochemisch durch Anlegen einer Spannung.[124][125] Eine andere Methode verwendet Kupfer(I)-chlorid oder Kupfer(II)-chlorid als Katalysator, Sauerstoff als stöchiometrisches Oxidationsmittel und zusätzlich ein Molsieb zum Abfangen des entstehenden Wassers.[126]
Sonstige Herstellungsverfahren
Durch die Carbocyanierung kann ein Nitril an eine Mehrfachbindung addiert werden, wobei ein weiteres Nitril erhalten wird. Beispielsweise können Arylnitrile unter Katalyse mit Dicyclooctadiennickel(0) und Trimethylphosphin an Alkine addiert werden, wodurch α,β-ungesättigte Nitrile erhalten werden. Mit gewissen Änderungen an den Reaktionsbedingungen, beispielsweise Verwendung eines anderen Phosphins oder Zusatz einer Lewis-Säure wie Trimethylaluminium oder Triphenylboran, können auch nichtaromatische Nitrile addiert werden, sowohl gesättigte als auch α,β-ungesättigte.[127] Es sind auch Carbocyanierungen bekannt, bei denen zwei Moleküle verbunden werden und zusätzlich eine Nitrilgruppe eingeführt wird. Dies funktioniert beispielsweise durch Einsatz von Hexabutyldistannan, sowie von Tosylcyanid als Quelle der Cyanidgruppe.[128]
Carbonsäuren können durch Umsetzung mit Indium(III)-chlorid in Acetonitril bei 200 °C in die entsprechenden Nitrile überführt werden. Dabei wirkt Acetonitril sowohl als Lösungsmittel als auch als Quelle für Stickstoffatome und wird bei der Reaktion zu Essigsäure umgesetzt. Die Reaktion verläuft über mehrere Mumm-Umlagerungen.[129]
N-Alkylamide können im Von-Braun-Abbau durch Umsetzung beispielsweise mit Phosphorpentachlorid in Nitrile umgewandelt werden.[130] Alternative Regenzien sind Phosphorpentabromid und Carbonylbromid.[131]
Acrylnitril, ein wichtiger Ausgangsstoff zur Herstellung verschiedener Polymere (siehe Abschnitt Verwendung), wird überwiegend durch Ammoxidation von Propylen hergestellt. Dabei reagiert Propylen mit Ammoniak und Luft zu Acrylnitril, wobei Wasser als Nebenprodukt anfällt.[132]
Herstellung von aromatischen Nitrilen

Die Herstellung von Arylnitrilen gelingt unter anderem durch die Sandmeyer-Reaktion von Aryldiazoniumsalzen mit Kupfer(I)-cyanid)[133] und durch die Rosenmund-von Braun-Reaktion (direkte Umsetzung eines Arylbromids mit Kupfer(I)-cyanid).[134] Umsetzung von Metallthiocyanaten mit aromatischen Carbonsäuren wird als Letts-Nitrilsynthese bezeichnet. Dafür kann beispielsweise Kaliumthiocyanat verwendet werden, aber Bleithiocyanat ergibt bessere Ergebnisse.[135]
Aryliodide können unter Palladiumkatalyse mit Trimethylsilylcyanid zu aromatischen Nitrilen umgesetzt werden. Beispielsweise ergibt die Reaktion von Iodbenzol mit Trimethylsilylcyanid und Tetrakis(triphenylphosphin)palladium(0) (Pd(PPh3)4) als Produkt Benzonitril.[136] Eine weitere Synthesemöglichkeit, die ebenfalls auf Palladiumkatalyse beruht (auch hierfür kann Pd(PPh3)4 eingesetzt werden) ist die Decarbonylierung aromatischer Carbonsäurecyanide.[137] Auch die palladiumkatalysierte Cyanierung von Arylchloriden mit Kaliumcyanid[138] oder Kaliumhexacyanidoferrat(II)[139] ist bekannt. Chinone können mit Trimethylsilylcyanid zu silylierten Cyanhydrinen umgesetzt werden und anschließend mit Phosphortribromid aromatisiert werden.[140] Eine weitere mögliche Synthese von Arylnitrilen ist die Umsetzung von Arylgrignard-Verbindungen oder Aryllithium-Verbindungen mit Dimethylmalonitril.[141]
Herstellung von Cyanhydrinen
Cyanhydrine können durch Addition eines Alkalicyanids an ein Aldehyd oder Keton in Gegenwart von Essigsäure hergestellt werden. Für unreaktive Substrate eignet sich auch Diethylaluminiumcyanid. Eine andere Method ist die Transhydrocyanierung, bei der Hydrogencyanid von Acetoncyanhydrin auf ein Aldehyd oder Keton übertragen wird.[3] Als Katalysatoren für letztere Reaktion eignen sich beispielsweise Alkoholate von Lanthaniden wie Lanthan(III)-isopropanolat, Cer(III)-isopropanolat, Samarium(III)-isopropanolat und Ytterbium(III)-isopropanolat.[142]
Bei der Addition von Trimethylsilylcyanid an Ketone oder Aldehyde entstehen Cyanhydrine als Trimethylsilylether.[143][144] Als Katalysatoren eignen sich beispielsweise Zinkiodid, Kaliumcyanid mit [18]Krone-6 oder Ytterbium(III)-cyanid.[3] Unter geeigneten Bedingungen können solche Reaktionen enantioselektiv erfolgen. Hierzu eignen sich beispielsweise Vanadium- oder Titankatalysatoren, die einen chiralen, Salen-ähnlichen Liganden trgen. Eine andere Möglichkeit ist die Verwendung von Titan(IV)-isopropanolat und einem chiralen Imin.[145][146]
Herstellung von Carbonsäurecyaniden
Carbonsäurecyanide beziehungsweise α-Oxonitrile können in einigen Fällen durch Umsetzung von Carbonsäurehalogeniden mit Übergangsmetallcyaniden (z. B. Kupfercyanid oder Silbercyanid) hergestellt werden. Dies funktioniert besonders gut mit aromatischen Carbonsäurehalogeniden und mit Carbonsäurebromiden, während aliphatische Carbonsäurechloride gar nicht reagieren. Aliphatische Carbonsäurecyanide lassen sich durch Reaktion von Carbonsäurechloriden mit Trimethylsilylcyanid herstellen.[147]
Enantioselektive Synthese chiraler Nitrile
Die enantioselektive Synthese von Nitrilen findet zunehmende Beachtung, weil sterisch einheitliche α-chirale Nitrile als Arzneistoffe (Vildagliptin, Saxagliptin) angewandt werden. Solche Herstellungsverfahren können von Chiral-Pool-Verbindungen ausgehen und standardmäßige Reaktionen zur Erzeugung der Nitrilfunktion verwenden. So kann ein enantiomerenreines Amid oder Oxim hergestellt werden, beispielsweise aus Prolin und dieses dehydratisiert werden. Wie zweckmäßig ein solches Verfahren ist, hängt allerdings vom jeweiligen Zielmolekül ab. Daneben sind auch asymmetrische Cyanierungsreaktionen bekannt.[148] Wichtig ist beispielsweise die asymmetrische Hydrocyanierung von Carbonylverbindungen, siehe hierzu den Abschnitt Herstellung von Cyanhydrinen. Daneben sind auch viele asymmetrische Hydrocyanierungen von Iminen bekannt, die zu enantiomerenreinen α-Aminonitrilen führen.[146]
Reaktionen
Die Nitrilfunktion hat eine große Bedeutung in der organischen Synthese, da sie einerseits über ein nucleophiles Stickstoffatom und ein elektrophiles Kohlenstoffatom verfügt, andererseits aber auch Komplexe bilden kann.[149]
Hydrolyse
Durch Hydrolyse von Nitrilen kann man Carbonsäuren herstellen. Die Hydrolyse kann sowohl sauer als auch basisch erfolgen, hierfür sind aber in der Regel drastische Bedingungen erforderlich. Bei der basischen Hydrolyse addiert sich ein Hydroxidion an das Nitril und bildet eine Imidoverbindung. Bei der sauren Hydrolyse wird das Nitril zunächst protoniert und dann unter Addition von Wasser ebenfalls eine Imidoverbindung gebildet. Die Imidoverbindung lagert sich in beiden Fällen zu einem Carbonsäureamid um, das unter den jeweiligen Bedingungen zu einer Carbonsäure weiterreagieren kann.[4]
Es sind auch Enzyme bekannt, die als Nitrilasen bezeichnet werden und die direkte Hydrolyse von Nitrilen zu Carbonsäuren ohne Amide als Zwischenstufe katalysieren.[150] Nitrile treten auch als Zwischenstufe bei der Strecker-Synthese auf. Hierbei wird ein Aldehyd mit Ammoniak und Cyanid umgesetzt, wobei zunächst ein α-Aminonitril entsteht. Dessen Hydrolyse ergibt eine alpha-Aminosäuren. Wegen der Bedeutung der Aminosäuren sowohl in der Natur als auch in der Industrie, hat die Strecker-Synthese eine enorme historische Bedeutung, ist aber auch heute noch wichtig.[151]
Reduktion
Nitrile können mit verschiedenen Reagenzien reduziert werden. Durch katalytische Hydrierung oder Umsetzung mit starken Hydridüberträgern wird so ein primäres Amin erhalten. Ein konkretes Beispiel ist hier Lihtiumaluminiumhydrid.[4] Weitere Reaktionssysteme, durch die Nitrile zu Aminen reduziert werden können, sind Raney-Nickel mit Kaliumborhydrid,[152] Raney-Nickel mit Hydraziniumformiat,[153] Raney-Cobalt,[154] Dimethoxyboran mit Cobaltborid oder Nickelborid,[155] und Rhodium auf Aluminium.[156] Die Hydrierung von Adiponitril zu Hexan-1,6-diamin ist ein wichtiger industrieller Prozess.[157]
Mit bestimmten Reagenzien (beispielsweise Diisobutylaluminiumhydrid) läuft die Reaktion nur bis zum Imin, durch dessen Hydrolyse ein Aldehyd erhalten werden kann.[4] Auch mittels der Stephen-Reduktion können aus Nitrilen Aldehyde erhalten werden. Dazu wird das Nitril mit Zinn(II)-chlorid und Chlorwasserstoff in Ether umgesetzt.[158]
Additionen von Kohlenstoff-Nucleophilen
Durch Addition von metallorganischen Verbingungen an Nitrile, beispielsweise mit Grignard-Reagenzien, entstehen Iminoverbindungen, deren Hydrolyse Ketone ergibt.[4] Die Addition sterisch gehinderter Verbindungen an Nitrile kann durch Zusatz von Kupfer(I)-bromid deutlich beschleunigt werden. Ein Beispiel ist die Umsetzung von Benzonitril mit tert-Butylmagnesiumchlorid, die ohne einen solchen Zusatz praktisch keinen Umsatz ergibt, mit dem Zusatz jedoch über 90 % innerhalb weniger Stunden.[159] Bei der Blaise-Reaktion wird aus einem α-Bromester, zum Beispiel Ethylbromacetat, ein Zinkenolat gebildet und dieses dann an ein Nitril addiert. Durch Hydrolyse wird ein β-Ketoester erhalten.[160]
Addition von Sauerstoff-Nucleophilen
In der Pinner-Reaktion werden unter saurer Katalyse Alkohole an Nitrile addiert, wodurch nach Neutralisation Imidate erhalten werden.[161][162] Bei einer neueren Variante der Reaktion wird als Lösungsmittel Cyclopentylmethylether verwendet.[163] Eine wichtige Reaktion, bei der ein Sauerstoff-Nucleophil an ein Nitril addiert wird, ist das Trichloracetimidat-Verfahren. Hierbei wird ein Saccharid durch Addition an Trichloracetonitril in ein Trichloracetimidat überführt und so aktiviert, was die Synthese von Oligosacchariden ermöglicht.[164][165] Eine weitere wichtige Anwendung von Imidaten ist die Overman-Umlagerung, eine Variante der Claisen-Umlagerung. Dabei wird ein Allylalkohol an Trichloracetonitril oder Trifluoracetonitril addiert. Das gebildetet Imidat wird zu einem N-Allylamid umgelagert.[166] Bei der Payne-Oxidation wird durch Addition eines Hydroperoxid-Ions an ein Nitril, z. B. Acetonitril oder Benzonitril, eine Imidopersäure gebildet. Diese eignen sich für die Epoxidierung von Alkenen, analog zu anderen Persäuren, wie meta-Chlorperbenzoesäure.[167][168]
Deprotonierung und α-Funktionalisierung
Die elektronenziehenden Eigenschaften der Nitrilgruppe ermöglichen die Herstellung von Carbanionen-Nucleophilen durch α-Deprotonierung.[5] Diese können beispielsweise für Alkylierungs- und Acylierungsreaktionen verwendet werden, allerdings kann die Deprotonierung auch zur Racemisierung chiraler Verbindungen führen.[169]
Reaktionen mit Aromaten
Die Nitrilgruppe von Arylnitrilen kann einen dirigierenden Effekt ausüben und beispielsweise die selektive Metallierung eines Aromaten in ortho-Position zum Nitril ermöglichen. Solche Arylmetallspezies können dann in Kupplungsreaktionen eingesetzt werden.[149]
Bei der Houben-Hoesch-Reaktion wird ein Aromat unter Säurekatalyse mit einem Nitril acyliert, ähnlich einer Friedel-Crafts-Acylierung. Nach hydrolytischer Aufarbeitung wird dabei ein Keton erhalten. Die Reaktion funktioniert insbesondere mit elektronenreichen Aromaten wie Phenol. Sie eignet sich auch für Cyclisierungen, wenn es sich um eine intramolekulare Reaktion handelt.[170]
Weitere Reaktionen
Die reduktive Decyanierung ermöglicht die Entfernung einer Nitrilgruppe, wenn diese beispielsweise wegen ihrer dirigierenden oder elektronenziehenden Eigenschaften verwendet wurde. Die klassische Methode zur reduktiven Decyanierung ist die Verwendung von elementaren Alkalimetallen mit einem Protonendonor, beispielsweise mit Natrium in Ammoniak oder Lithium in Ethylamin.[5] Ein weiteres Beispiel ist die Verwendung von Kalium auf Aluminiumoxid in Hexan.[171] Vor allem aromatische Nitrile können auch mti Übergangsmetallkatalysatoren defunktionialisiert werden, beispielsweise auf der Basis von Nickel oder Cobalt.[5]
Bei der Ritter-Reaktion wird ein Alken oder ein tertiärer Alkohol mit einem Nitril und Schwefelsäure umgesetzt, wodurch ein N-Alkylamid gebildet wird, wobei das Alken oder der Alkohol den Substituenten am Stickstoff ergibt.[172]
[4+2]-Cycloaddition von Nitrilen mit Dienen sind kaum bekannt und von untergeordneter Bedeutung. Die [2+2+2]-Cycloaddition eines Nitril mit zwei Alkinen wird beispielsweise durch Nickelverbindungen katalysiert und ermöglicht die Herstellung stark substituierter Pyridine.[149] Auch Reaktionen mit Cobalt und Zirconium als Katalysatoren sind bekannt.[173][174] Die [3+2]-Cycloaddition von Nitrilen mit Aziden beziehungsweise Stickstoffwasserstoffsäure ergibt Tetrazole.[149][175]
Verwendung
Acrylnitril ist ein wichtiger Ausgangsstoff zur Herstellung von Nitril-Polymeren. Acetonitril ist ein wichtiges Lösungsmittel. Weitere Nitrile werden beispielsweise als Duftstoffe und chemische Reagenzien eingesetzt. Außerdem spielt die Nitrilgruppe eine wichtige Rolle in der Entwicklung von pharmazeutischen Wirkstoffen und ist in diversen solcher Wirkstoffen enthalten.
Kunststoffherstellung
Diverse weitverbreitete Polymere enthalten Acrylnitril als Monomer und weisen daher Nitrilgruppen auf. Reines Polyacrylnitril (PAN) lässt sich schlecht verarbeiten, weshalb Polyacrylnitril neben 85 bis 99 % Acrylnitril fast immer kleine Mengen anderer Monomere enthält.[132] Verwendet werden daneben auch Copolymere, die zwischen 35 und 85 % Acrylnitril als Monomer enthalten, neben anderen Monomeren wie Vinylacetat und Methylmethacrylat.[132][176] Diese verschiedenen Polymere sind neben Polyestern und Polyamiden eines der wichtigsten vollsynthetischen Materialien für Textilfasern.[132][177] Diese Fasern werden als Acrylfasern bezeichnet und in einer Größenordnung von mehreren Millionen Tonnen pro Jahr hergestellt, beispielsweise etwa 2,7 Millionen Tonnen im Jahr 2000.[132][178] Verwendet werden Acrylfasern unter anderem in Bekleidung (z. B. Socken und Pullover) sowie für Decken, Teppiche und Strickgarn.[132][179] PAN ist außerdem der wichtigste Ausgangsstoff zur Herstellung von Carbonfasern, die als extrem leichtes aber gleichzeitig stabiles Material zum Beispiel für Autos und Flugzeuge verwendet werden.[132][176][180][181]

Acrylnitril-Butadien-Copolymere werden als Nitrilkautschuk bezeichnet und haben verschiedene vorteilhafte Eigenschaften wie hohe Zugfestigkeit und Abriebfestigkeit, sowie Beständigkeit gegen Kohlenwasserstoffe (z. B. Öl und Treibstoffe). Sie werden daher beispielsweise für Dichtungsringe und Öl- und Treibstoffschläuche verwendet.[132] Eine weitere wichtige Anwendung von Nitrilkautschuk sind Schutzhandschuhe, die oft statt Handschuhen aus Latex im Gesundheitswesen verwendet werden, da letztere regelmäßig Allergien verursachen.[182] Solche Handschuhe werden außerdem oft bei der Arbeit mit gefährlichen Chemikalien (z. B. organischen Lösungsmitteln) verwendet.[183]
Ein weiteres wichtiges Polymer ist das Terpolymer aus Acrylnitril, Butadien und Styrol (ABS). Dieses ist eines der wichtigsten Materialien für Außenhüllen von elektronischen Geräten (z. B. Computer, Bildschirme und Tastaturen).[184] Weitere Verwendungen sind Plastikteile von Autos (z. B. an Scheinwerfern und Spiegeln); Einsätze für Kühlschränke; Außenhüllen von Küchengeräten, Staubsaugern und Elektrowerkzeugen; sowie Koffer und Vesperdosen.[185] Ein weiterer Anwendungsbereich sind Spielzeuge, darunter beispielsweise Lego-Steine.[186][187] Auch ABS wird in der Größenordnung von mehreren Millionen Tonnen pro Jahr produziert, beispielsweise etwa 2,7 Millionen Tonnen im Jahr 1992.[185]
Polyamid 6.6 (Nylon) ist kein Nitril, allerdings ist ein Schlüsselintermediat zu seiner Herstellung das Adiponitril. Adiponitril wird durch Hydrocyanierung von Butadien oder durch Dimerisierung von Acrylnitril hergestellt und durch katalytische Hydrierung zu Hexamethylendiamin umgesetzt, welches eines der Monomere für Nylon ist. Das zweite Monomer, Adipinsäure wird durch Oxidation von Cyclohexan gewonnen.[188][189]
Chemisch-pharmazeutische Industrie und Labore
Acetonitril findet als Lösungsmittel Verwendung, insbesondere in der pharmazeutischen Industrie.[190] Es ist außerdem eines der wichtigsten Lösungsmittel für Analysen mittels HPLC.[190][191] Die Zersetzung von Azobisisobutyronitril (AIBN) und verwandten Verbindungen (z. B. Azobiscyclohexancarbonitril) ergibt vergleichsweise stabile Radikale, weshalb diese Verbindungen als Radikalstarter für verschiedene Reaktionen (v. a. Polymerisationen) verwendet werden.[192] Das Chinon DDQ, das über zwei Nitrilgruppen verfügt, ist ein weitverbreitetes Oxidationsmittel, das auch in der pharmazeutischen Industrie verwendet wird.[193] Die Nitrilgruppe lässt sich als Sonde für infrarot-spektroskopische Untersuchungen in Biomoleküle einführen.[194]
Nitrile in der Medizin
Eine größere Zahl an Nitrilen werden als pharmazeutische Wirkstoffe eingesetzt. Beispielsweise wurde zwischen 2010 und 2020 jedes Jahr mindestens ein Wirkstoff mit Nitrilfunktion von der FDA zugelassen. Die Nitrilgruppe hat charakteristische physikalische und chemische Eigenschaften, die im Design von pharmazeutischen Wirkstoffen eine wichtige Rolle spielen. Die Nitrilgruppe hat eine lineare Geometrie und beansprucht nur sehr wenig Raum, etwa ein Achtel im Vergleich zu einer Methylgruppe, wodurch sie gut geeignet ist, um die Form eines Wirkstoffmoleküls an die Bindungstasche eines Zielproteins anzupassen. Die Einführung einer Nitrilgruppe in ein Molekül führt im Allgemeinen zu einem geringen Octanol-Wasser-Verteilungskoeffizienten, also besserer Wasserlöslichkeit, was verschiedene Vorteile wie eine höhere Bioverfügbarkeit und eine höhere Halbwertszeit bringt. Durch ihren starken elektronenziehenden Effekt kann sie die Elektronendichte in aromatischen Ringen beeinflussen, die dadurch unter Umständen zusätzliche Interaktionen mit dem Zielproteinen eingehen können. Zudem ist die Nitrilgruppe isoster zur Carbonylgruppe, der Hydroxylgruppe und zum Chloratom. Sie hat also ähnliche elektronische und geometrische Eigenschaften wie diese und kann gegen diese ausgetauscht werden um die Moleküleigenschaften leicht zu variieren. In einigen Fällen dient die Nitrilgruppe als Warhead für einen kovalenten Inhibitor, also eine Gruppe, durch die Wirkstoffmolekül und Zielprotein kovalent verbunden werden.[195]
Verapamil ist ein Calciumkanal-Blocker, der bei Herz-Kreislauf-Erkrankungen, beispielsweise Bluthochdruck und Angina pectoris, eingesetzt wird.[196] Die Nitrilgruppe im Molekül koordiniert an ein Calciumion, das an einer bestimmten Position des Proteins vorliegt, was wichtig für die Bindungseigenschaften ist.[197]
Sonstige Verwendungen
Eine zweistellige Anzahl an Nitrilen wird als Duftstoffe für Kosmetika verwendet. Dazu gehören unter anderem Zimtsäurenitril, Dodecannitril und Benzonitril.[198][199]
Cyanacrylate werden als Sekundenkleber verwendet, da sie als Einkomponentenzubereitung schnell bei normalen Umgebungsbedingungen aushärten und viele Materialien kleben können. Die bei weitem meistgenutzte Verbindung in diesem Bereich ist Ethylcyanacrylat, in geringerem Maße werden beispielsweise Methylcyanacrylat und Allylcyanacrylat verwendet.[200] Cyanacrylatkleber werden auch im medizinischen Bereich verwendet, um Wunden zu verkleben, anstatt sie zu nähen. Da Ester mit kurzkettigen Alkylresten (wie Methylcyanacrylat) aber oft Nebenwirkungen, insbesondere Entzündungen, verursachen, werden hier andere Verbindungen verwendet als im technischen Bereich. So kommen vor allem Butylcyanacrylat und Octylcyanacrylat zum Einsatz.[201]
Nitrile finden Verwendung als Elektrolytzusatzmittel in Lithiumbatterien. So bewirkt beispielsweise der Zusatz von 1,3,6-Hexantricarbonitril eine signifikante Zunahme der Leistung gegenüber einer entsprechenden Batterie ohne Zusatz. Die Wirkweise der Nitrilzusätze ist noch nicht vollständig geklärt.[202][203]
Einzelnachweise
- ↑ a b c Muthupandian Ganesan, Paramathevar Nagaraaj: Recent developments in dehydration of primary amides to nitriles. In: Organic Chemistry Frontiers. Band 7, Nr. 22, 2020, S. 3792–3814, doi:10.1039/D0QO00843E.
- ↑ Arthur Lapworth: XCVI.—Reactions involving the addition of hydrogen cyanide to carbon compounds. In: J. Chem. Soc., Trans. Band 83, Nr. 0, 1903, S. 995–1005, doi:10.1039/CT9038300995.
- ↑ a b c d e Robert J. H. Gregory: Cyanohydrins in Nature and the Laboratory: Biology, Preparations, and Synthetic Applications. In: Chemical Reviews. Band 99, Nr. 12, 8. Dezember 1999, S. 3649–3682, doi:10.1021/cr9902906.
- ↑ a b c d e f g Kurt Peter C. Vollhardt, Neil Eric Schore: Organische Chemie. Hauptbd. 5. Auflage. Wiley-VCH, Weinheim 2011, ISBN 978-3-527-32754-6.
- ↑ a b c d Jean-Marc R Mattalia: The reductive decyanation reaction: an overview and recent developments. In: Beilstein Journal of Organic Chemistry. Band 13, 13. Februar 2017, S. 267–284, doi:10.3762/bjoc.13.30, PMID 28326136, PMC 5331330 (freier Volltext).
- ↑ K. Bowden, R. Stewart: Strongly basic systems—V. In: Tetrahedron. Band 21, Nr. 3, Januar 1965, S. 261–266, doi:10.1016/S0040-4020(01)98266-3.
- ↑ Theresa Soltner, Jonas Häusler, Andreas J. Kornath: The Existence of Tricyanomethane. In: Angewandte Chemie International Edition. Band 54, Nr. 46, 9. November 2015, S. 13775–13776, doi:10.1002/anie.201506753.
- ↑ Yeon-Ran Shin, Sun-Min Jung, In-Yup Jeon, Jong-Beom Baek: The oxidation mechanism of highly ordered pyrolytic graphite in a nitric acid/sulfuric acid mixture. In: Carbon. Band 52, Februar 2013, S. 493–498, doi:10.1016/j.carbon.2012.10.001.
- ↑ O. W. Webster: Polycyanation. The Reaction of Cyanogen Chloride, Cyclopentadiene, and Sodium Hydride. In: Journal of the American Chemical Society. Band 88, Nr. 13, Juli 1966, S. 3046–3050, doi:10.1021/ja00965a028.
- ↑ Robert E. Kitson, Norman E. Griffith: Infrared Absorption Band Due to Nitrile Stretching Vibration. In: Analytical Chemistry. Band 24, Nr. 2, 18. Februar 1952, S. 334–337, doi:10.1021/ac60062a019.
- ↑ a b Eintrag zu Acetonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Dezember 2023. (JavaScript erforderlich)
- ↑ a b Eintrag zu Propionitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Dezember 2023. (JavaScript erforderlich)
- ↑ a b Eintrag zu Butyronitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Dezember 2023. (JavaScript erforderlich)
- ↑ a b Eintrag zu Isobutyronitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Dezember 2023. (JavaScript erforderlich)
- ↑ a b Eintrag zu Acrylnitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Dezember 2023. (JavaScript erforderlich)
- ↑ a b Eintrag zu Benzonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Dezember 2023. (JavaScript erforderlich)
- ↑ a b c d Fraser F. Fleming, Fraser F. Fleming: Nitrile-containing natural products. In: Natural Product Reports. Band 16, Nr. 5, 1999, S. 597–606, doi:10.1039/a804370a.
- ↑ a b c d Camille Scotti, James W. Barlow: Natural Products Containing the Nitrile Functional Group and Their Biological Activities. In: Natural Product Communications. Band 17, Nr. 5, Mai 2022, S. 1934578X2210999, doi:10.1177/1934578X221099973.
- ↑ Anete C Ferraz, Miriam Elizabeth M Angelucci, Mariana L Da Costa, Ilza R Batista, Bras H De Oliveira, Claudio Da Cunha: Pharmacological Evaluation of Ricinine, a Central Nervous System Stimulant Isolated from Ricinus communis. In: Pharmacology Biochemistry and Behavior. Band 63, Nr. 3, Juli 1999, S. 367–375, doi:10.1016/S0091-3057(99)00007-6.
- ↑ R. Mukherjee, A. Chatterjee: Structure and synthesis of nudiflorine. In: Tetrahedron. Band 22, Nr. 4, Januar 1966, S. 1461–1466, doi:10.1016/S0040-4020(01)99443-8.
- ↑ M.Soledade C Pedras, Corwin M Nycholat, Sabine Montaut, Yiming Xu, Abdul Q Khan: Chemical defenses of crucifers: elicitation and metabolism of phytoalexins and indole-3-acetonitrile in brown mustard and turnip. In: Phytochemistry. Band 59, Nr. 6, März 2002, S. 611–625, doi:10.1016/S0031-9422(02)00026-2.
- ↑ A. Bellirou, A. Bouali, B. Bouammali, N. Boukhatem, B.N. Elmtili, A. Hamal, M. El-Mourabit: Extraction of simmondsin and oil in one step from jojoba seeds. In: Industrial Crops and Products. Band 21, Nr. 2, März 2005, S. 229–233, doi:10.1016/j.indcrop.2004.04.007.
- ↑ Adolf Nahrstedt, Victor Wray: Structural revision of a putative cyanogenic glucoside from Ilex aquifolium. In: Phytochemistry. Band 29, Nr. 12, 1990, S. 3934–3936, doi:10.1016/0031-9422(90)85364-L.
- ↑ Wendy K. Swenson, John E. Dunn, Eric E. Conn: Cyanogenesis in Acacia sutherlandii. In: Phytochemistry. Band 26, Nr. 6, Januar 1987, S. 1835–1836, doi:10.1016/S0031-9422(00)82299-2.
- ↑ Martin G. Ettlinger, Jerzy W. Jaroszewski, S�ren Rosendal Jensen, Bent Juhl Nielsen, Frederick Nartey: Proacacipetalin and acacipetalin. In: Journal of the Chemical Society, Chemical Communications. Nr. 24, 1977, S. 952, doi:10.1039/c39770000952.
- ↑ K Shanker, M Gupta, S Srivastava, D Bawankule, A Pal, S Khanuja: Determination of bioactive nitrile glycoside(s) in drumstick (Moringa oleifera) by reverse phase HPLC. In: Food Chemistry. Band 105, Nr. 1, 2007, S. 376–382, doi:10.1016/j.foodchem.2006.12.034.
- ↑ F. W. Stamler: Reproduction in Rats Fed Lathyrus Peas or Aminonitriles. In: Experimental Biology and Medicine. Band 90, Nr. 1, 1. Oktober 1955, S. 294–298, doi:10.3181/00379727-90-22013.
- ↑ E. D. Schilling, F. M. Strong: ISOLATION, STRUCTURE AND SYNTHESIS OF A LATHYRUS FACTOR FROM L. ODORATUS 1. In: Journal of the American Chemical Society. Band 76, Nr. 10, Mai 1954, S. 2848–2848, doi:10.1021/ja01639a084.
- ↑ Mohammadali Torbati, Hossein Nazemiyeh, Farzaneh Lotfipour, Solmaz Asnaashari, Mahboob Nemati, Fatemeh Fathiazad: Composition and Antibacterial Activity of Heracleum Transcaucasicum and Heracleum Anisactis Aerial Parts Essential Oil. In: Advanced Pharmaceutical Bulletin; eISSN 2251-7308. 2013, doi:10.5681/APB.2013.066, PMID 24312869, PMC 3848220 (freier Volltext).
- ↑ Peter Lorenz, Sarina Duckstein, Jürgen Conrad, Matthias Knödler, Ulrich Meyer, Florian C. Stintzing: An Approach to the Chemotaxonomic Differentiation of Two European Dog's Mercury Species: Mercurialis annua L. and M. perennis L. In: Chemistry & Biodiversity. Band 9, Nr. 2, Februar 2012, S. 282–297, doi:10.1002/cbdv.201100341.
- ↑ K.L. Mikolajczak: Cyanolipids. In: Progress in the Chemistry of Fats and other Lipids. Band 15, Nr. 2, Januar 1977, S. 97–130, doi:10.1016/0079-6832(77)90013-1.
- ↑ David S. Seigler, Wanda Kawahara: New reports of cyanolipids from sapindaceous plants. In: Biochemical Systematics and Ecology. Band 4, Nr. 4, Januar 1976, S. 263–265, doi:10.1016/0305-1978(76)90050-8.
- ↑ Hieng-Ming Ting, Boon Huat Cheah, Yu-Cheng Chen, Pei-Min Yeh, Chiu-Ping Cheng, Freddy Kuok San Yeo, Ane Kjersti Vie, Jens Rohloff, Per Winge, Atle M. Bones, Ralph Kissen: The Role of a Glucosinolate-Derived Nitrile in Plant Immune Responses. In: Frontiers in Plant Science. Band 11, 10. März 2020, doi:10.3389/fpls.2020.00257, PMID 32211010, PMC 7076197 (freier Volltext).
- ↑ Adam M. Wentzell, Daniel J. Kliebenstein: Genotype, Age, Tissue, and Environment Regulate the Structural Outcome of Glucosinolate Activation. In: Plant Physiology. Band 147, Nr. 1, 28. April 2008, S. 415–428, doi:10.1104/pp.107.115279, PMID 18359845, PMC 2330308 (freier Volltext).
- ↑ Hideji Tanii: Allyl nitrile: Toxicity and health effects. In: Journal of Occupational Health. Band 59, Nr. 2, März 2017, S. 104–111, doi:10.1539/joh.16-0147-RA, PMID 28132970, PMC 5478528 (freier Volltext).
- ↑ Jinghua Yang, Zhangping Li, Jinmin Lian, Guoning Qi, Pibiao Shi, Jiawei He, Zhongyuan Hu, Mingfang Zhang: Brassicaceae transcriptomes reveal convergent evolution of super-accumulation of sinigrin. In: Communications Biology. Band 3, Nr. 1, 16. Dezember 2020, doi:10.1038/s42003-020-01523-x, PMID 33328568, PMC 7745032 (freier Volltext).
- ↑ David J. Williams, Christa Critchley, Sharon Pun, Mridusmita Chaliha, Timothy J. O’Hare: Differing mechanisms of simple nitrile formation on glucosinolate degradation in Lepidium sativum and Nasturtium officinale seeds. In: Phytochemistry. Band 70, Nr. 11-12, Juli 2009, S. 1401–1409, doi:10.1016/j.phytochem.2009.07.035.
- ↑ Ani Radonić, Ivica Blažević, Josip Mastelić, Marina Zekić, Mirjana Skočibušić, Ana Maravić: Phytochemical Analysis and Antimicrobial Activity of Cardaria draba (L.) Desv . Volatiles. In: Chemistry & Biodiversity. Band 8, Nr. 6, Juni 2011, S. 1170–1181, doi:10.1002/cbdv.201000370.
- ↑ Islamiyat F. Bolarinwa, Caroline Orfila, Michael R.A. Morgan: Amygdalin content of seeds, kernels and food products commercially-available in the UK. In: Food Chemistry. Band 152, Juni 2014, S. 133–139, doi:10.1016/j.foodchem.2013.11.002.
- ↑ C.J Graham: Nonstructural carbohydrate and prunasin composition of peach seedlings fertilized with different nitrogen sources and aluminum. In: Scientia Horticulturae. Band 94, Nr. 1-2, Mai 2002, S. 21–32, doi:10.1016/S0304-4238(01)00345-4.
- ↑ C.J Graham: Nonstructural carbohydrate and prunasin composition of peach seedlings fertilized with different nitrogen sources and aluminum. In: Scientia Horticulturae. Band 94, Nr. 1-2, Mai 2002, S. 21–32, doi:10.1016/S0304-4238(01)00345-4.
- ↑ Jandirk Sendker, Therese Ellendorff, Aljoscha Hölzenbein: Occurrence of Benzoic Acid Esters as Putative Catabolites of Prunasin in Senescent Leaves of Prunus laurocerasus. In: Journal of Natural Products. Band 79, Nr. 7, 22. Juli 2016, S. 1724–1729, doi:10.1021/acs.jnatprod.5b01090.
- ↑ David Chassagne, Jean C. Crouzet, Claude L. Bayonove, Raymond L. Baumes: Identification and Quantification of Passion Fruit Cyanogenic Glycosides. In: Journal of Agricultural and Food Chemistry. Band 44, Nr. 12, 1. Januar 1996, S. 3817–3820, doi:10.1021/jf960381t.
- ↑ David S. Seigler, Guido F. Pauli, Adolf Nahrstedt, Rosemary Leen: Cyanogenic allosides and glucosides from Passiflora edulis and Carica papaya. In: Phytochemistry. Band 60, Nr. 8, August 2002, S. 873–882, doi:10.1016/S0031-9422(02)00170-X.
- ↑ Mateja Senica, Franci Stampar, Robert Veberic, Maja Mikulic‐Petkovsek: The higher the better? Differences in phenolics and cyanogenic glycosides in Sambucus nigra leaves, flowers and berries from different altitudes. In: Journal of the Science of Food and Agriculture. Band 97, Nr. 8, Juni 2017, S. 2623–2632, doi:10.1002/jsfa.8085.
- ↑ Rex A. Buhrmester, John E. Ebinger, David S. Seigler: Sambunigrin and cyanogenic variability in populations of Sambucus canadensis L. (Caprifoliaceae). In: Biochemical Systematics and Ecology. Band 28, Nr. 7, August 2000, S. 689–695, doi:10.1016/S0305-1978(99)00105-2.
- ↑ Nhat Hao Tran Le, Karl Egil Malterud, Drissa Diallo, Berit Smestad Paulsen, Cecilie Sogn Nergård, Helle Wangensteen: Bioactive polyphenols in Ximenia americana and the traditional use among Malian healers. In: Journal of Ethnopharmacology. Band 139, Nr. 3, Februar 2012, S. 858–862, doi:10.1016/j.jep.2011.12.031.
- ↑ H. Kofod, R. Eyjólfsson: Cyanogenesis in species of the fern genera Cystopteris and Davalla. In: Phytochemistry. Band 8, Nr. 8, August 1969, S. 1509–1511, doi:10.1016/S0031-9422(00)85922-1.
- ↑ Gilles F. Nicollier, Daniel F. Pope, Alonzo C. Thompson: Biological activity of dhurrin and other compounds from Johnson grass (Sorghum halepense). In: Journal of Agricultural and Food Chemistry. Band 31, Nr. 4, Juli 1983, S. 744–748, doi:10.1021/jf00118a016.
- ↑ Tomas Laursen, Jonas Borch, Camilla Knudsen, Krutika Bavishi, Federico Torta, Helle Juel Martens, Daniele Silvestro, Nikos S. Hatzakis, Markus R. Wenk, Timothy R. Dafforn, Carl Erik Olsen, Mohammed Saddik Motawia, Björn Hamberger, Birger Lindberg Møller, Jean-Etienne Bassard: Characterization of a dynamic metabolon producing the defense compound dhurrin in sorghum. In: Science. Band 354, Nr. 6314, 18. November 2016, S. 890–893, doi:10.1126/science.aag2347.
- ↑ G.W. Butler: The distribution of the cyanoglucosides linamarin and lotaustralin in higher plants. In: Phytochemistry. Band 4, Nr. 1, Februar 1965, S. 127–131, doi:10.1016/S0031-9422(00)86154-3.
- ↑ M. P. Cereda, M.C.Y. Mattos: LINAMARIN: THE TOXIC COMPOUND OF CASSAVA. In: Journal of Venomous Animals and Toxins. Band 2, Nr. 1, 1996, S. 06–12, doi:10.1590/S0104-79301996000100002.
- ↑ Matthias Onyebuchi Agbo, Daowan Lai, Festus B.C. Okoye, Patience O. Osadebe, Peter Proksch: Antioxidative polyphenols from Nigerian mistletoe Loranthus micranthus (Linn.) parasitizing on Hevea brasiliensis. In: Fitoterapia. Band 86, April 2013, S. 78–83, doi:10.1016/j.fitote.2013.02.006.
- ↑ R. Lieberei, D. Selmar, B. Biehl: Metabolization of cyanogenic glucosides inHevea brasiliensis. In: Plant Systematics and Evolution. Band 150, Nr. 1-2, 1985, S. 49–63, doi:10.1007/BF00985567.
- ↑ a b Mika Zagrobelny, Érika de Castro, Birger Møller, Søren Bak: Cyanogenesis in Arthropods: From Chemical Warfare to Nuptial Gifts. In: Insects. Band 9, Nr. 2, 3. Mai 2018, S. 51, doi:10.3390/insects9020051, PMID 29751568, PMC 6023451 (freier Volltext).
- ↑ Ritsuo Nishida, Miriam Rothschild, Rosemary Mummery: Acyanoglucoside, sarmentosin, from the magpie moth, Abraxas grossulariata, geometridae: Lepidoptera. In: Phytochemistry. Band 36, Nr. 1, Mai 1994, S. 37–38, doi:10.1016/S0031-9422(00)97007-9.
- ↑ Nanna Bjarnholt, Mirosław Nakonieczny, Andrzej Kędziorski, Diane M. Debinski, Stephen F. Matter, Carl Erik Olsen, Mika Zagrobelny: Occurrence of Sarmentosin and Other Hydroxynitrile Glucosides in Parnassius (Papilionidae) Butterflies and Their Food Plants. In: Journal of Chemical Ecology. Band 38, Nr. 5, Mai 2012, S. 525–537, doi:10.1007/s10886-012-0114-x.
- ↑ J. R. Aldrich, S. P. Carroll, W. R. Lusby, M. J. Thompson, J. P. Kochansky, R. M. Waters: Sapindaceae, cyanolipids, and bugs. In: Journal of Chemical Ecology. Band 16, Nr. 1, Januar 1990, S. 199–210, doi:10.1007/BF01021279.
- ↑ J.C. Braekman, D. Daloze, J.M. Pasteels: Cyanogenic and other glucosides in a neo-guinean bug Leptocoris isolata: Possible precursors in its host-plant. In: Biochemical Systematics and Ecology. Band 10, Nr. 4, Dezember 1982, S. 355–364, doi:10.1016/0305-1978(82)90010-2.
- ↑ Mika Zagrobelny, Karsten Scheibye-Alsing, Niels Bjerg Jensen, Birger Lindberg Møller, Jan Gorodkin, Søren Bak: 454 pyrosequencing based transcriptome analysis of Zygaena filipendulae with focus on genes involved in biosynthesis of cyanogenic glucosides. In: BMC Genomics. Band 10, Nr. 1, Dezember 2009, doi:10.1186/1471-2164-10-574, PMID 19954531, PMC 2791780 (freier Volltext).
- ↑ Adolf Nahrstedt: Cyanogenesis and foodplants. In: Phytochemistry and Agriculture. Oxford University PressOxford, 1993, ISBN 978-0-19-857762-1, S. 107–129.
- ↑ Ljubodrag V. Vujisić, Ivan M. Vučković, Slobodan E. Makarov, Bojan S. Ilić, Dragan Ž. Antić, Milka B. Jadranin, Nina M. Todorović, Ivan V. Mrkić, Vlatka E. Vajs, Luka R. Lučić, Božidar P. M. Ćurčić, Bojan M. Mitić: Chemistry of the sternal gland secretion of the Mediterranean centipede Himantarium gabrielis (Linnaeus, 1767) (Chilopoda: Geophilomorpha: Himantariidae). In: Naturwissenschaften. Band 100, Nr. 9, September 2013, S. 861–870, doi:10.1007/s00114-013-1086-6.
- ↑ Karsten Seidelmann, Heike Weinert, Hans-Jörg Ferenz: Wings and legs are production sites for the desert locust courtship-inhibition pheromone, phenylacetonitrile. In: Journal of Insect Physiology. Band 49, Nr. 12, Dezember 2003, S. 1125–1133, doi:10.1016/j.jinsphys.2003.08.005.
- ↑ S. S. Duffey, M. S. Blum, H. M. Fales, S. L. Evans, R. W. Roncadori, D. L. Tiemann, Y. Nakagawa: Benzoyl cyanide and mandelonitrile benzoate in the defensive secretions of millipedes. In: Journal of Chemical Ecology. Band 3, Nr. 1, 1977, S. 101–113, doi:10.1007/BF00988137.
- ↑ Adrian Brückner, Günther Raspotnig, Katja Wehner, Reinhard Meusinger, Roy A. Norton, Michael Heethoff: Storage and release of hydrogen cyanide in a chelicerate ( Oribatula tibialis ). In: Proceedings of the National Academy of Sciences. Band 114, Nr. 13, 28. März 2017, S. 3469–3472, doi:10.1073/pnas.1618327114, PMID 28289203, PMC 5380029 (freier Volltext).
- ↑ Guido Cimino, Margherita Gavagnin, Guido Sodano, Aldo Spinella, Giuseppe Strazzullo, Francis J. Schmitz, Gopichand Yalamanchili: Revised structure of bursatellin. In: The Journal of Organic Chemistry. Band 52, Nr. 11, Mai 1987, S. 2301–2303, doi:10.1021/jo00387a037.
- ↑ Annika Fagerholm, Damien Habrant, Ari M. Koskinen: Calyculins and Related Marine Natural Products as Serine- Threonine Protein Phosphatase PP1 and PP2A Inhibitors and Total Syntheses of Calyculin A, B, and C. In: Marine Drugs. Band 8, Nr. 1, 21. Januar 2010, S. 122–172, doi:10.3390/md80100122, PMID 20161975, PMC 2817927 (freier Volltext).
- ↑ Samuele Sala, Jane Fromont, Oliver Gomez, Daniel Vuong, Ernest Lacey, Gavin R. Flematti: Albanitriles A–G: Antiprotozoal Polyacetylene Nitriles from a Mycale Marine Sponge. In: Journal of Natural Products. Band 82, Nr. 12, 27. Dezember 2019, S. 3450–3455, doi:10.1021/acs.jnatprod.9b00840.
- ↑ Hideyuki Takahashi, Koohei Nozawa, Ken-ichi Kawai: Isolation and Structures of Dicyanide Derivatives, Epurpurins A to C, from Emericella purpurea. In: Chemical and Pharmaceutical Bulletin. Band 44, Nr. 12, 1996, S. 2227–2230, doi:10.1248/cpb.44.2227.
- ↑ Marjorie Anchel: Metabolic products of Clitocybe diatreta. I. Diatretyne amide and diatretyne nitrile. In: Archives of Biochemistry and Biophysics. Band 78, Nr. 1, November 1958, S. 100–110, doi:10.1016/0003-9861(58)90318-7.
- ↑ N. G. Heatley, J. S. Stephenson: Identity of ‘Nudic Acid B’ and ‘Diatretyne II’. In: Nature. Band 179, Nr. 4569, Mai 1957, S. 1078–1078, doi:10.1038/1791078a0.
- ↑ Jan Caspar, Peter Spiteller: A Free Cyanohydrin as Arms and Armour of Marasmius oreades. In: ChemBioChem. Band 16, Nr. 4, 2. März 2015, S. 570–573, doi:10.1002/cbic.201402453.
- ↑ Diogo Montes Vidal, Anna‐Lena von Rymon‐Lipinski, Srinivasa Ravella, Ulrike Groenhagen, Jennifer Herrmann, Nestor Zaburannyi, Paulo H. G. Zarbin, Adithi R. Varadarajan, Christian H. Ahrens, Laure Weisskopf, Rolf Müller, Stefan Schulz: Long‐Chain Alkyl Cyanides: Unprecedented Volatile Compounds Released by Pseudomonas and Micromonospora Bacteria. In: Angewandte Chemie International Edition. Band 56, Nr. 15, 3. April 2017, S. 4342–4346, doi:10.1002/anie.201611940.
- ↑ Joel P. Cioni, James R. Doroghazi, Kou-San Ju, Xiaomin Yu, Bradley S. Evans, Jaeheon Lee, William W. Metcalf: Cyanohydrin Phosphonate Natural Product from Streptomyces regensis. In: Journal of Natural Products. Band 77, Nr. 2, 28. Februar 2014, S. 243–249, doi:10.1021/np400722m, PMID 24437999, PMC 3993929 (freier Volltext).
- ↑ Sanjoy Adak, April L. Lukowski, Rebecca J. B. Schäfer, Bradley S. Moore: From Tryptophan to Toxin: Nature’s Convergent Biosynthetic Strategy to Aetokthonotoxin. In: Journal of the American Chemical Society. Band 144, Nr. 7, 23. Februar 2022, S. 2861–2866, doi:10.1021/jacs.1c12778, PMID 35142504, PMC 9004672 (freier Volltext).
- ↑ Max P. Bernstein, Samantha F. M. Ashbourn, Scott A. Sandford, Louis J. Allamandola: The Lifetimes of Nitriles (CN) and Acids (COOH) during Ultraviolet Photolysis and Their Survival in Space. In: The Astrophysical Journal. Band 601, Nr. 1, 20. Januar 2004, S. 365–370, doi:10.1086/380306.
- ↑ Richard Carter, Mary M. Nijhout: Control of Gamete Formation (Exflagellation) in Malaria Parasites. In: Science. Band 195, Nr. 4276, 28. Januar 1977, S. 407–409, doi:10.1126/science.12566.
- ↑ Jean-Claude Guillemin, Miloud Bouyahyi, El Hassan Riague: Prebiotic, planetary and interstellar chemistry starting from compounds detected in the interstellar medium. In: Advances in Space Research. Band 33, Nr. 1, Januar 2004, S. 81–87, doi:10.1016/j.asr.2003.07.015.
- ↑ a b Yannick Vallee, Ibrahim Shalayel, Kieu-Dung Ly, K. V. Raghavendra Rao, Gael De Paëpe, Katharina Märker, Anne Milet: At the very beginning of life on Earth: the thiol-rich peptide (TRP) world hypothesis. In: The International Journal of Developmental Biology. Band 61, Nr. 8-9, 2017, S. 471–478, doi:10.1387/ijdb.170028yv.
- ↑ a b Nicholas F. Wogan, David C. Catling, Kevin J. Zahnle, Roxana Lupu: Origin-of-life Molecules in the Atmosphere after Big Impacts on the Early Earth. In: The Planetary Science Journal. Band 4, Nr. 9, 1. September 2023, S. 169, doi:10.3847/PSJ/aced83.
- ↑ L. Chimiak, J. Eiler, A. Sessions, C. Blumenfeld, M. Klatte, B.M. Stoltz: Isotope effects at the origin of life: Fingerprints of the Strecker synthesis. In: Geochimica et Cosmochimica Acta. Band 321, März 2022, S. 78–98, doi:10.1016/j.gca.2022.01.015.
- ↑ Ibrahim Shalayel, Seydou Coulibaly, Kieu Ly, Anne Milet, Yannick Vallée: The Reaction of Aminonitriles with Aminothiols: A Way to Thiol-Containing Peptides and Nitrogen Heterocycles in the Primitive Earth Ocean. In: Life. Band 8, Nr. 4, 19. Oktober 2018, S. 47, doi:10.3390/life8040047, PMID 30347745, PMC 6316830 (freier Volltext).
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 22. Auflage, 1991, ISBN 3-7776-0485-2, S. 266–269.
- ↑ Eintrag zu nitriles. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.N04151 – Version: 2.3.3.
- ↑ Eintrag zu carbonitriles. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C00838 – Version: 2.3.3.
- ↑ a b Thomas Laue, Andreas Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. In: Teubner Studienbücher Chemie. 1994, doi:10.1007/978-3-322-94726-0.
- ↑ K. R. Lynn, Peter E. Yankwich: Cyanide Carbon Isotope Fractionation in the Reaction of Cyanide Ion and Methyl Iodide. Carbon Isotope Effect in the Hydrolysis of Methyl Iodide. In: Journal of the American Chemical Society. Band 83, Nr. 1, Januar 1961, S. 53–57, doi:10.1021/ja01462a010.
- ↑ G. E. Ham, Jane Stevens: Reaction of 1,2-Dihaloethanes with Sodium Cyanide. In: The Journal of Organic Chemistry. Band 27, Nr. 12, Dezember 1962, S. 4638–4639, doi:10.1021/jo01059a504.
- ↑ Cinzia Chiappe, Daniela Pieraccini, Paola Saullo: Nucleophilic Displacement Reactions in Ionic Liquids: Substrate and Solvent Effect in the Reaction of NaN 3 and KCN with Alkyl Halides and Tosylates. In: The Journal of Organic Chemistry. Band 68, Nr. 17, 1. August 2003, S. 6710–6715, doi:10.1021/jo026838h.
- ↑ W. Nagata, M. Yoshioka, S. Hirai: Hydrocyanation. IV. New hydrocyanation methods using hydrogen cyanide and an alkylaluminum, and an alkylaluminum cyanide. In: Journal of the American Chemical Society. Band 94, Nr. 13, Juni 1972, S. 4635–4643, doi:10.1021/ja00768a037.
- ↑ W. Nagata, M. Yoshioka, T. Okumura: Hydrocyanation. Part X. Cleavage of epoxides with hydrogen cyanide and triethylaluminium and with diethylaluminium cyanide. In: Journal of the Chemical Society C: Organic. Nr. 17, 1970, S. 2365, doi:10.1039/j39700002365.
- ↑ Jeffrey C. Mullis, William P. Weber: Regiospecificity of reactions of epoxides and oxetanes with trimethylsilyl cyanide. In: The Journal of Organic Chemistry. Band 47, Nr. 15, Juli 1982, S. 2873–2875, doi:10.1021/jo00136a011.
- ↑ a b Dilip Konwar, Monalisa Boruah, Gautom Kumar Sarmah, Nayan Kamal Bhattacharyya, Naleen Borthakur, Birendra Nath Goswami, Kumar Ranjan Boruah: Aluminium Chloride and Sodium Iodide (AlCl3-NaI): A Versatile Dehydrating Agent. In: Journal of Chemical Research. Band 2001, Nr. 11, November 2001, S. 490–492, doi:10.3184/030823401103168604.
- ↑ a b Imen Talbi, Mohamed Lotfi Efrit, Soufiane Touil: Efficient New Protocols for Converting Primary Amides into Nitriles Initiated by P(NMe 2 ) 3 , PCl 3 , or P(OPh) 3. In: ACS Omega. Band 3, Nr. 5, 31. Mai 2018, S. 5078–5082, doi:10.1021/acsomega.8b00544, PMID 31458722, PMC 6641971 (freier Volltext).
- ↑ Muthupandian Ganesan: Methods for Direct Conversion of Primary Nitroalkanes to Nitriles. In: Current Organic Chemistry. Band 25, Nr. 24, 22. Dezember 2021, S. 2990–3003, doi:10.2174/1385272825666211126124835.
- ↑ Z. Shahsavari-Fard, A. R. Sardarian: Diethyl chlorophosphate: A new alternative reagent for dehydration of primary amides to nitriles in solvent and solvent-free conditions. In: Journal of the Iranian Chemical Society. Band 8, Nr. 1, März 2011, S. 204–208, doi:10.1007/BF03246217.
- ↑ 2-ETHYLHEXANONITRILE. In: Organic Syntheses. Band 32, 1952, S. 65, doi:10.15227/orgsyn.032.0065.
- ↑ Mohammed H. Al‐Huniti, Mitchell P. Croatt: Metal‐Catalyzed Dehydration of Primary Amides to Nitriles. In: Asian Journal of Organic Chemistry. Band 8, Nr. 10, Oktober 2019, S. 1791–1799, doi:10.1002/ajoc.201900343.
- ↑ Hiroyuki Okabe, Asuka Naraoka, Takahiro Isogawa, Shunsuke Oishi, Hiroshi Naka: Acceptor-Controlled Transfer Dehydration of Amides to Nitriles. In: Organic Letters. Band 21, Nr. 12, 21. Juni 2019, S. 4767–4770, doi:10.1021/acs.orglett.9b01657.
- ↑ Stephan Enthaler: Straightforward Iron‐Catalyzed Synthesis of Nitriles by Dehydration of Primary Amides. In: European Journal of Organic Chemistry. Band 2011, Nr. 25, September 2011, S. 4760–4763, doi:10.1002/ejoc.201100754.
- ↑ Stephan Enthaler: Straightforward Uranium‐Catalyzed Dehydration of Primary Amides to Nitriles. In: Chemistry – A European Journal. Band 17, Nr. 34, 16. August 2011, S. 9316–9319, doi:10.1002/chem.201101478.
- ↑ Stephan Enthaler, Shigeyoshi Inoue: An Efficient Zinc‐Catalyzed Dehydration of Primary Amides to Nitriles. In: Chemistry – An Asian Journal. Band 7, Nr. 1, 2. Januar 2012, S. 169–175, doi:10.1002/asia.201100493.
- ↑ Shekharappa, L. Roopesh Kumar, C. Srinivasulu, Vommina V. Sureshbabu: Dehydration of Chiral α-Amides to Chiral α-Nitriles Under the Appel Reaction Conditions. In: International Journal of Peptide Research and Therapeutics. Band 27, Nr. 1, März 2021, S. 497–502, doi:10.1007/s10989-020-10101-y.
- ↑ Richard S. Monson, Deggary N. Priest: Dehydration of Amides to Nitriles Initiated by Hexamethylphosphoric Triamide. In: Canadian Journal of Chemistry. Band 49, Nr. 17, 1. September 1971, S. 2897–2898, doi:10.1139/v71-480.
- ↑ Rui Ding, Yongguo Liu, Mengru Han, Wenyi Jiao, Jiaqi Li, Hongyu Tian, Baoguo Sun: Synthesis of Nitriles from Primary Amides or Aldoximes under Conditions of a Catalytic Swern Oxidation. In: The Journal of Organic Chemistry. Band 83, Nr. 20, 19. Oktober 2018, S. 12939–12944, doi:10.1021/acs.joc.8b02190.
- ↑ Kazuaki Ishihara, Yoshiro Furuya, Hisashi Yamamoto: Rhenium(VII) Oxo Complexes as Extremely Active Catalysts in the Dehydration of Primary Amides and Aldoximes to Nitriles. In: Angewandte Chemie. Band 114, Nr. 16, 16. August 2002, S. 3109, doi:10.1002/1521-3757(20020816)114:16<3109::AID-ANGE3109>3.0.CO;2-K.
- ↑ Jiban K. Chakrabarti, Terrence M. Hotten: A new route to nitriles. Dehydration of aldoximes using 2,4,6-trichloro-s-triazine (cyanuric chloride). In: Journal of the Chemical Society, Chemical Communications. Nr. 22, 1972, S. 1226, doi:10.1039/c39720001226.
- ↑ Mild and Efficient Dehydration of Oximes to Nitriles Mediated by the Burgess Reagent. In: Synlett. Band 2000, Nr. 08, 2000, S. 1169–1171, doi:10.1055/s-2000-6752.
- ↑ Ziad Moussa, Saleh A. Ahmed, Ahmad S. ElDouhaibi, Shaya Y. Al-Raqa: NMR Studies and electrophilic properties of triphenylphosphine–trifluoromethanesulfonic anhydride; a remarkable dehydrating reagent system for the conversion of aldoximes into nitriles. In: Tetrahedron Letters. Band 51, Nr. 14, April 2010, S. 1826–1831, doi:10.1016/j.tetlet.2010.01.119.
- ↑ Kengo Hyodo, Saki Kitagawa, Masayuki Yamazaki, Kingo Uchida: Iron‐Catalyzed Dehydration of Aldoximes to Nitriles Requiring Neither Other Reagents Nor Nitrile Media. In: Chemistry – An Asian Journal. Band 11, Nr. 9, 6. Mai 2016, S. 1348–1352, doi:10.1002/asia.201600085.
- ↑ Philipp Rommelmann, Tobias Betke, Harald Gröger: Synthesis of Enantiomerically Pure N -Acyl Amino Nitriles via Catalytic Dehydration of Oximes and Application in a de Novo Synthesis of Vildagliptin. In: Organic Process Research & Development. Band 21, Nr. 10, 20. Oktober 2017, S. 1521–1527, doi:10.1021/acs.oprd.7b00169.
- ↑ a b Kazuya Yamaguchi, Hiroshi Fujiwara, Yoshiyuki Ogasawara, Miyuki Kotani, Noritaka Mizuno: A Tungsten–Tin Mixed Hydroxide as an Efficient Heterogeneous Catalyst for Dehydration of Aldoximes to Nitriles. In: Angewandte Chemie. Band 119, Nr. 21, 18. Mai 2007, S. 3996–3999, doi:10.1002/ange.200605004.
- ↑ Dongliang Zhang, Yaping Huang, Erlei Zhang, Rong Yi, Chao Chen, Lei Yu, Qing Xu: Pd/Mn Bimetallic Relay Catalysis for Aerobic Aldoxime Dehydration to Nitriles. In: Advanced Synthesis & Catalysis. Band 360, Nr. 4, 15. Februar 2018, S. 784–790, doi:10.1002/adsc.201701154.
- ↑ Tobias Betke, Jun Higuchi, Philipp Rommelmann, Keiko Oike, Taiji Nomura, Yasuo Kato, Yasuhisa Asano, Harald Gröger: Biocatalytic Synthesis of Nitriles through Dehydration of Aldoximes: The Substrate Scope of Aldoxime Dehydratases. In: ChemBioChem. Band 19, Nr. 8, 16. April 2018, S. 768–779, doi:10.1002/cbic.201700571.
- ↑ Liyuan Lan, Shuai Huang, Yongguo Liu, Baoguo Sun, Hongyu Tian: Preparation and odor characteristics of nitriles derived from aldehydes. In: Flavour and Fragrance Journal. Band 35, Nr. 4, Juli 2020, S. 425–434, doi:10.1002/ffj.3581.
- ↑ Dylan J. Quinn, Graham J. Haun, Gustavo Moura-Letts: Direct synthesis of nitriles from aldehydes with hydroxylamine-O-sulfonic acid in acidic water. In: Tetrahedron Letters. Band 57, Nr. 34, August 2016, S. 3844–3847, doi:10.1016/j.tetlet.2016.07.047.
- ↑ Xiao-De An, Shouyun Yu: Direct Synthesis of Nitriles from Aldehydes Using an O -Benzoyl Hydroxylamine (BHA) as the Nitrogen Source. In: Organic Letters. Band 17, Nr. 20, 16. Oktober 2015, S. 5064–5067, doi:10.1021/acs.orglett.5b02547.
- ↑ Antonella Leggio, Emilia Lucia Belsito, Sonia Gallo, Angelo Liguori: One-pot conversion of aldehydes to nitriles mediated by TiCl 4. In: Tetrahedron Letters. Band 58, Nr. 15, April 2017, S. 1512–1514, doi:10.1016/j.tetlet.2017.03.007.
- ↑ Lewis Acid Reagents Edited by H. Yamamoto. Oxford University Press: Oxford, UK. 1999. 270 pp. £75.00. ISBN 0 19 850099 8. In: Organic Process Research & Development. Band 3, Nr. 4, 15. April 1999, S. 292–292, doi:10.1021/op990022+.
- ↑ Jitendra Gurjar, Jorick Bater, Valery V. Fokin: Sulfuryl Fluoride Mediated Conversion of Aldehydes to Nitriles. In: Chemistry – A European Journal. Band 25, Nr. 8, 6. Februar 2019, S. 1906–1909, doi:10.1002/chem.201805175.
- ↑ Albert M. van Leusen, Piet G. Oomkes: One-Step Conversion of Aldehydes to Nitriles. Introduction of a One-Carbon Unit. In: Synthetic Communications. Band 10, Nr. 5, Januar 1980, S. 399–403, doi:10.1080/00397918008061830.
- ↑ Otto H. Oldenziel, Daan Van Leusen, Albert M. Van Leusen: Chemistry of sulfonylmethyl isocyanides. 13. A general one-step synthesis of nitriles from ketones using tosylmethyl isocyanide. Introduction of a one-carbon unit. In: The Journal of Organic Chemistry. Band 42, Nr. 19, September 1977, S. 3114–3118, doi:10.1021/jo00439a002.
- ↑ Niamh Disney, Megan Smyth, Scott Wharry, Thomas S. Moody, Marcus Baumann: A cyanide-free synthesis of nitriles exploiting flow chemistry. In: Reaction Chemistry & Engineering. 2024, doi:10.1039/D3RE00458A.
- ↑ M. F. Semmelhack, Christopher R. Schmid: Nitroxyl-mediated electro-oxidation of amines to nitriles and carbonyl compounds. In: Journal of the American Chemical Society. Band 105, Nr. 22, Oktober 1983, S. 6732–6734, doi:10.1021/ja00360a042.
- ↑ Kyle M. Lambert, James M. Bobbitt, Sherif A. Eldirany, Liam E. Kissane, Rose K. Sheridan, Zachary D. Stempel, Francis H. Sternberg, William F. Bailey: Metal‐Free Oxidation of Primary Amines to Nitriles through Coupled Catalytic Cycles. In: Chemistry – A European Journal. Band 22, Nr. 15, 4. April 2016, S. 5156–5159, doi:10.1002/chem.201600549.
- ↑ Yasunari Maeda, Takahiro Nishimura, Sakae Uemura: Copper-Catalyzed Oxidation of Amines with Molecular Oxygen. In: Bulletin of the Chemical Society of Japan. Band 76, Nr. 12, Dezember 2003, S. 2399–2403, doi:10.1246/bcsj.76.2399.
- ↑ Yoshiaki Nakao, Tamejiro Hiyama: Nickel-catalyzed carbocyanation of alkynes. In: Pure and Applied Chemistry. Band 80, Nr. 5, 1. Januar 2008, S. 1097–1107, doi:10.1351/pac200880051097.
- ↑ Haitham Hassan, Vincent Pirenne, Maren Wissing, Chahinaz Khiar, Ashique Hussain, Frédéric Robert, Yannick Landais: Free‐Radical Carbocyanation of Olefins. In: Chemistry – A European Journal. Band 23, Nr. 19, 3. April 2017, S. 4651–4658, doi:10.1002/chem.201605946.
- ↑ Laurent Vanoye, Ahmad Hammoud, Hélène Gérard, Alexandra Barnes, Régis Philippe, Pascal Fongarland, Claude de Bellefon, Alain Favre-Réguillon: Direct Synthesis of Nitriles from Carboxylic Acids Using Indium-Catalyzed Transnitrilation: Mechanistic and Kinetic Study. In: ACS Catalysis. Band 9, Nr. 11, 1. November 2019, S. 9705–9714, doi:10.1021/acscatal.9b02779.
- ↑ Walter-Georg Veeck, Manfred Regitz: Triple-bonded Heteroatom Derivatives Other Than Nitriles with Another Heteroatom Attached to the sp-Carbon Atom. In: Comprehensive Organic Functional Group Transformations. Elsevier, 1995, S. 1151–1160.
- ↑ B.A. Phillips, G. Fodor, J. Gal, F. Letourneau, J.J. Ryan: Mechanism of the von Braun amide degradations with carbonyl bromide or phosphorus pentabromide. In: Tetrahedron. Band 29, Nr. 21, Januar 1973, S. 3309–3327, doi:10.1016/S0040-4020(01)93483-0.
- ↑ a b c d e f g h Polyacrylonitrile. In: Handbook of Thermoplastics. CRC Press, 2016, ISBN 978-0-429-10162-5, S. 157–186.
- ↑ Irina P. Beletskaya, Alexander S. Sigeev, Alexander S. Peregudov, Pavel V. Petrovskii: Catalytic Sandmeyer cyanation as a synthetic pathway to aryl nitriles. In: Journal of Organometallic Chemistry. Band 689, Nr. 23, November 2004, S. 3810–3812, doi:10.1016/j.jorganchem.2004.07.019.
- ↑ C. Frederick Koelsch: Some Applications of the Rosenmund-v. Braun Nitrile Synthesis. In: Journal of the American Chemical Society. Band 58, Nr. 8, August 1936, S. 1328–1330, doi:10.1021/ja01299a004.
- ↑ David T. Mowry: The Preparation of Nitriles. In: Chemical Reviews. Band 42, Nr. 2, 1. April 1948, S. 189–283, doi:10.1021/cr60132a001.
- ↑ Naoto Chatani, Terukiyo Hanafusa: Transition-metal-catalyzed reactions of trimethylsilyl cyanide. 4. Palladium-catalyzed cyanation of aryl halides by trimethylsilyl cyanide. In: The Journal of Organic Chemistry. Band 51, Nr. 24, November 1986, S. 4714–4716, doi:10.1021/jo00374a041.
- ↑ Shunichi Murahashi, Takeshi Naota, Nobuyuki Nakajima: Palladium-catalyzed decarbonylation of acyl cyanides. In: The Journal of Organic Chemistry. Band 51, Nr. 6, März 1986, S. 898–901, doi:10.1021/jo00356a029.
- ↑ Mark Sundermeier, Alexander Zapf, Matthias Beller, Jürgen Sans: A new palladium catalyst system for the cyanation of aryl chlorides. In: Tetrahedron Letters. Band 42, Nr. 38, September 2001, S. 6707–6710, doi:10.1016/S0040-4039(01)01390-9.
- ↑ Todd D. Senecal, Wei Shu, Stephen L. Buchwald: A General, Practical Palladium‐Catalyzed Cyanation of (Hetero)Aryl Chlorides and Bromides. In: Angewandte Chemie. Band 125, Nr. 38, 16. September 2013, S. 10219–10223, doi:10.1002/ange.201304188.
- ↑ Florian Glöcklhofer, Markus Lunzer, Johannes Fröhlich: Facile Synthesis of Cyanoarenes from Quinones by Reductive Aromatization of Cyanohydrin Intermediates. In: Synlett. Band 26, Nr. 07, 1. April 2015, S. 950–952, doi:10.1055/s-0034-1380150.
- ↑ Jonathan T. Reeves, Christian A. Malapit, Frederic G. Buono, Kanwar P. Sidhu, Maurice A. Marsini, C. Avery Sader, Keith R. Fandrick, Carl A. Busacca, Chris H. Senanayake: Transnitrilation from Dimethylmalononitrile to Aryl Grignard and Lithium Reagents: A Practical Method for Aryl Nitrile Synthesis. In: Journal of the American Chemical Society. Band 137, Nr. 29, 29. Juli 2015, S. 9481–9488, doi:10.1021/jacs.5b06136.
- ↑ Hiroshi Ohno, Atsunori Mori, Shohei Inoue: Lanthanoid(III) Alkoxides as Novel Catalysts for a Rapid Transhydrocyanation from Acetone Cyanohydrin to Aldehydes and Ketones. In: Chemistry Letters. Band 22, Nr. 2, Februar 1993, S. 375–378, doi:10.1246/cl.1993.375.
- ↑ David A. Evans, Gary L. Carroll, Larry K. Truesdale: Synthetic applications of trimethylsilyl cyanide. Efficient synthesis of .beta.-aminomethyl alcohols. In: The Journal of Organic Chemistry. Band 39, Nr. 7, April 1974, S. 914–917, doi:10.1021/jo00921a012.
- ↑ Shu Kobayashi, Yoshikazu Tsuchiya, Teruaki Mukaiyama: A Facile Synthesis of Cyanohydrin Trimethylsilyl Ethers by the Addition Reaction of Trimethylsilyl Cyanide with Aldehydes under Basic Condition. In: Chemistry Letters. Band 20, Nr. 4, April 1991, S. 537–540, doi:10.1246/cl.1991.537.
- ↑ Yuri N. Belokon', Susana Caveda-Cepas, Brendan Green, Nicolai S. Ikonnikov, Viktor N. Khrustalev, Vladimir S. Larichev, Margarita A. Moscalenko, Michael North, Charles Orizu, Vitali I. Tararov, Michela Tasinazzo, Galina I. Timofeeva, Lidia V. Yashkina: The Asymmetric Addition of Trimethylsilyl Cyanide to Aldehydes Catalyzed by Chiral (Salen)Titanium Complexes. In: Journal of the American Chemical Society. Band 121, Nr. 16, 1. April 1999, S. 3968–3973, doi:10.1021/ja984197v.
- ↑ a b Nobuhito Kurono, Takeshi Ohkuma: Catalytic Asymmetric Cyanation Reactions. In: ACS Catalysis. Band 6, Nr. 2, 5. Februar 2016, S. 989–1023, doi:10.1021/acscatal.5b02184.
- ↑ Siegfried Hünig, Rainer Schaller: The Chemistry of Acyl Cyanides. In: Angewandte Chemie International Edition in English. Band 21, Nr. 1, Januar 1982, S. 36–49, doi:10.1002/anie.198200361.
- ↑ Harald Gröger, Yasuhisa Asano: Cyanide-Free Enantioselective Catalytic Strategies for the Synthesis of Chiral Nitriles. In: The Journal of Organic Chemistry. doi:10.1021/acs.joc.9b02773.
- ↑ a b c d Amitava Rakshit, Hirendra Nath Dhara, Ashish Kumar Sahoo, Bhisma K. Patel: The Renaissance of Organo Nitriles in Organic Synthesis. In: Chemistry – An Asian Journal. Band 17, Nr. 21, 2. November 2022, doi:10.1002/asia.202200792.
- ↑ V. G. Debabov, A. S. Yanenko: Biocatalytic hydrolysis of nitriles. In: Review Journal of Chemistry. Band 1, Nr. 4, Oktober 2011, S. 385–402, doi:10.1134/S2079978011030010.
- ↑ Wayiza Masamba: Petasis vs. Strecker Amino Acid Synthesis: Convergence, Divergence and Opportunities in Organic Synthesis. In: Molecules. Band 26, Nr. 6, 18. März 2021, S. 1707, doi:10.3390/molecules26061707, PMID 33803879, PMC 8003338 (freier Volltext).
- ↑ Bo Wu, Ji Zhang, Meng Yang, Yang Yue, Li-Jian Ma, Xiao-Qi Yu: Raney Ni/KBH4: An efficient and mild system for the reduction of nitriles to amines. In: Arkivoc. Band 2008, Nr. 12, 4. April 2008, S. 95–102, doi:10.3998/ark.5550190.0009.c11.
- ↑ Shankare Gowda, D.Channe Gowda: Application of hydrazinium monoformate as new hydrogen donor with Raney nickel: a facile reduction of nitro and nitrile moieties. In: Tetrahedron. Band 58, Nr. 11, März 2002, S. 2211–2213, doi:10.1016/S0040-4020(02)00093-5.
- ↑ P Scharringer, T Muller, J Lercher: Investigations into the mechanism of the liquid-phase hydrogenation of nitriles over Raney-Co catalysts. In: Journal of Catalysis. Band 253, Nr. 1, 1. Januar 2008, S. 167–179, doi:10.1016/j.jcat.2007.10.008.
- ↑ Atsuko Nose, Tadahiro Kudo: Studies of reduction with dimethoxyborane-transition metal boride systems. In: Chemical and Pharmaceutical Bulletin. Band 38, Nr. 6, 1990, S. 1720–1723, doi:10.1248/cpb.38.1720.
- ↑ Morris Freifelder: A Low Pressure Process for the Reduction of Nitriles. Use of Rhodium Catalyst 1. In: Journal of the American Chemical Society. Band 82, Nr. 9, Mai 1960, S. 2386–2389, doi:10.1021/ja01494a067.
- ↑ R Ramachandran: An overview of industrial uses of hydrogen. In: International Journal of Hydrogen Energy. Band 23, Nr. 7, Juli 1998, S. 593–598, doi:10.1016/S0360-3199(97)00112-2.
- ↑ Siegfried R. Waldvogel: Strategic Applications of Named Reactions in Organic Synthesis. Background and Detailed Mechanisms. By Laszlo Kürti and Barbara Czako. In: Angewandte Chemie International Edition. Band 44, Nr. 32, 8. August 2005, S. 5005–5006, doi:10.1002/anie.200585304.
- ↑ Franz J. Weiberth, Stan S. Hall: Copper(I)-activated addition of Grignard reagents to nitriles. Synthesis of ketimines, ketones, and amines. In: The Journal of Organic Chemistry. Band 52, Nr. 17, August 1987, ISSN 0022-3263, S. 3901–3904, doi:10.1021/jo00226a033 (acs.org [abgerufen am 28. Dezember 2023]).
- ↑ H. Surya Prakash Rao, Shaik Rafi, K. Padmavathy: The Blaise reaction. In: Tetrahedron. Band 64, Nr. 35, August 2008, S. 8037–8043, doi:10.1016/j.tet.2008.05.109.
- ↑ Adolf Pinner: Die Imidoäther und ihre Derivate. Robert Oppenheim, 1892, ISBN 978-0-598-98239-1.
- ↑ Andriani G. Chaidali, Ioannis N. Lykakis: Synthetic Routes to Imidates and Their Applications in Organic Transformation: Recent Progress. In: European Journal of Organic Chemistry. Band 26, Nr. 39, 16. Oktober 2023, ISSN 1434-193X, doi:10.1002/ejoc.202300497 (wiley.com [abgerufen am 28. Dezember 2023]).
- ↑ Kiyoshi Watanabe, Naoto Kogoshi, Hideaki Miki, Yasuhiro Torisawa: Improved Pinner Reaction with CPME as a Solvent. In: Synthetic Communications. Band 39, Nr. 11, 7. Mai 2009, ISSN 0039-7911, S. 2008–2013, doi:10.1080/00397910802632548 (tandfonline.com [abgerufen am 28. Dezember 2023]).
- ↑ Richard R. Schmidt, Josef Michel: Facile Synthesis of α‐ and β‐ O ‐Glycosyl Imidates; Preparation of Glycosides and Disaccharides. In: Angewandte Chemie International Edition in English. Band 19, Nr. 9, September 1980, S. 731–732, doi:10.1002/anie.198007311.
- ↑ You Yang, Xiaheng Zhang, Biao Yu: O-Glycosylation methods in the total synthesis of complex natural glycosides. In: Natural Product Reports. Band 32, Nr. 9, 2015, S. 1331–1355, doi:10.1039/C5NP00033E.
- ↑ Rodney A. Fernandes, Pullaiah Kattanguru, Sachin P. Gholap, Dipali A. Chaudhari: Recent advances in the Overman rearrangement: synthesis of natural products and valuable compounds. In: Organic & Biomolecular Chemistry. Band 15, Nr. 13, 2017, S. 2672–2710, doi:10.1039/C6OB02625G.
- ↑ Daisuke Uraguchi, Ryosuke Tsutsumi, Takashi Ooi: Catalytic asymmetric Payne oxidation under the catalysis of P-spiro chiral triaminoiminophosphorane: application to the synthesis of N-sulfonyl oxaziridines. In: Tetrahedron. Band 70, Nr. 8, Februar 2014, S. 1691–1701, doi:10.1016/j.tet.2013.12.086.
- ↑ George B. Payne, Philip H. Deming, Paul H. Williams: Reactions of Hydrogen Peroxide. VII. Alkali-Catalyzed Epoxidation and Oxidation Using a Nitrile as Co-reactant. In: The Journal of Organic Chemistry. Band 26, Nr. 3, März 1961, S. 659–663, doi:10.1021/jo01062a004.
- ↑ Frederick G. Bordwell, Herbert E. Fried: Acidities of the hydrogen-carbon protons in carboxylic esters, amides, and nitriles. In: The Journal of Organic Chemistry. Band 46, Nr. 22, Oktober 1981, S. 4327–4331, doi:10.1021/jo00335a001.
- ↑ Yasuo Sato, Michihisa Yato, Tomohiko Ohwada, Shinichi Saito, Koichi Shudo: Involvement of Dicationic Species as the Reactive Intermediates in Gattermann, Houben-Hoesch, and Friedel-Crafts Reactions of Nonactivated Benzenes. In: Journal of the American Chemical Society. Band 117, Nr. 11, März 1995, S. 3037–3043, doi:10.1021/ja00116a009.
- ↑ Diego Savoia, Emilio Tagliavini, Claudio Trombini, Achille Umani-Ronchi: Potassium on alumina as a reagent for reductive decyanation of alkylnitriles. In: The Journal of Organic Chemistry. Band 45, Nr. 16, August 1980, S. 3227–3229, doi:10.1021/jo01304a016.
- ↑ Ghodsi Mohammadi Ziarani, Fatemeh Soltani Hasankiadeh, Fatemeh Mohajer: Recent Applications of Ritter Reactions in Organic Syntheses. In: ChemistrySelect. Band 5, Nr. 45, 7. Dezember 2020, S. 14349–14379, doi:10.1002/slct.202003470.
- ↑ Barbara Heller, Marko Hapke: The fascinating construction of pyridine ring systems by transition metal-catalysed [2 + 2 + 2] cycloaddition reactions. In: Chemical Society Reviews. Band 36, Nr. 7, 2007, S. 1085, doi:10.1039/b607877j.
- ↑ Kaili Cen, Muhammad Usman, Wangzhen Shen, Meijing Liu, Rong Yang, Jinhui Cai: A review on the assembly of multi-substituted pyridines via Co-catalyzed [2 + 2 + 2] cycloaddition with nitriles. In: Organic & Biomolecular Chemistry. Band 20, Nr. 37, 2022, S. 7391–7404, doi:10.1039/D2OB01344D.
- ↑ Rakhi Vishwakarma, Chandrakanth Gadipelly, Lakshmi Kantam Mannepalli: Advances in Tetrazole Synthesis – An Overview. In: ChemistrySelect. Band 7, Nr. 29, 5. August 2022, doi:10.1002/slct.202200706.
- ↑ a b Arman Sedghi, Reza Eslami Farsani, Ali Shokuhfar: The effect of commercial polyacrylonitrile fibers characterizations on the produced carbon fibers properties. In: Journal of Materials Processing Technology. Band 198, Nr. 1-3, März 2008, S. 60–67, doi:10.1016/j.jmatprotec.2007.06.052.
- ↑ Md Abdullah Al Faruque, Rechana Remadevi, Joselito Razal, Xungai Wang, Maryam Naebe: Investigation on structure and characteristics of alpaca‐based wet‐spun polyacrylonitrile composite fibers by utilizing natural textile waste. In: Journal of Applied Polymer Science. Band 137, Nr. 7, 15. Februar 2020, doi:10.1002/app.48370.
- ↑ B. E. Geller: [No title found]. In: Fibre Chemistry. Band 34, Nr. 3, 2002, S. 151–161, doi:10.1023/A:1020525628197.
- ↑ P. Bajaj, Surya Kumari: Modification of Acrylic Fibers: An Overview. In: Journal of Macromolecular Science, Part C: Polymer Reviews. Band 27, Nr. 2, Mai 1987, S. 181–217, doi:10.1080/07366578708081915.
- ↑ T.A. Adegbola, O. Agboola, O.S.I. Fayomi: Review of polyacrylonitrile blends and application in manufacturing technology: recycling and environmental impact. In: Results in Engineering. Band 7, September 2020, S. 100144, doi:10.1016/j.rineng.2020.100144.
- ↑ Xing Jin, Chunfang Feng, Claudia Creighton, Nishar Hameed, Jyotishkumar Parameswaranpillai, Nisa V. Salim: On the structural evolution of textile grade polyacrylonitrile fibers during stabilization and carbonization: Towards the manufacture of low‐cost carbon fiber. In: Polymer Degradation and Stability. Band 186, 1. April 2021, S. 109536, doi:10.1016/j.polymdegradstab.2021.109536.
- ↑ J. Sawyer: Comparing the Level of Dexterity offered by Latex and Nitrile SafeSkin Gloves. In: Annals of Occupational Hygiene. Band 50, Nr. 3, 12. Dezember 2005, S. 289–296, doi:10.1093/annhyg/mei066.
- ↑ Keh-Ping Chao, Pak-Hing Lee, Min-Jet Wu: Organic solvents permeation through protective nitrile gloves. In: Journal of Hazardous Materials. Band 99, Nr. 2, April 2003, S. 191–201, doi:10.1016/S0304-3894(03)00042-6.
- ↑ L. B. Brennan, D. H. Isaac, J. C. Arnold: Recycling of acrylonitrile–butadiene–styrene and high‐impact polystyrene from waste computer equipment. In: Journal of Applied Polymer Science. Band 86, Nr. 3, 17. Oktober 2002, S. 572–578, doi:10.1002/app.10833.
- ↑ a b Acrylonitrile-butadiene-styrene copolymers. In: Encyclopedic Dictionary of Polymers. Springer New York, New York, NY 2006, S. 22–22.
- ↑ Francesca Sabatini, Silvia Pizzimenti, Irene Bargagli, Ilaria Degano, Celia Duce, Laura Cartechini, Francesca Modugno, Francesca Rosi: A Thermal Analytical Study of LEGO® Bricks for Investigating Light-Stability of ABS. In: Polymers. Band 15, Nr. 15, 31. Juli 2023, S. 3267, doi:10.3390/polym15153267.
- ↑ Zhijuan Wang, Hongyan Li, Tao Li, Qing Zhang, Yaqi Cai, Hua Bai, Qing Lv: Application of validated migration models for the risk assessment of styrene and acrylonitrile in ABS plastic toys. In: Ecotoxicology and Environmental Safety. Band 252, März 2023, S. 114570, doi:10.1016/j.ecoenv.2023.114570.
- ↑ Alex Tullo: Industry braces for nylon 6,6 shortage. In: C&EN Global Enterprise. Band 96, Nr. 40, 8. Oktober 2018, S. 22–23, doi:10.1021/cen-09640-feature3.
- ↑ Younghyun Lee, Sung Woo Lee, Hyung Ju Kim, Yong Tae Kim, Kun-Yi Andrew Lin, Jechan Lee: Hydrogenation of Adiponitrile to Hexamethylenediamine over Raney Ni and Co Catalysts. In: Applied Sciences. Band 10, Nr. 21, 26. Oktober 2020, S. 7506, doi:10.3390/app10217506.
- ↑ a b Ian F. McConvey, Dean Woods, Moira Lewis, Quan Gan, Paul Nancarrow: The Importance of Acetonitrile in the Pharmaceutical Industry and Opportunities for its Recovery from Waste. In: Organic Process Research & Development. Band 16, Nr. 4, 20. April 2012, S. 612–624, doi:10.1021/op2003503.
- ↑ Cristiano Soleo Funari, Renato Lajarim Carneiro, Manish M. Khandagale, Alberto José Cavalheiro, Emily F. Hilder: Acetone as a greener alternative to acetonitrile in liquid chromatographic fingerprinting. In: Journal of Separation Science. Band 38, Nr. 9, Mai 2015, S. 1458–1465, doi:10.1002/jssc.201401324.
- ↑ Ladislav Androvič, Jan Bartáček, Miloš Sedlák: Recent advances in the synthesis and applications of azo initiators. In: Research on Chemical Intermediates. Band 42, Nr. 6, Juni 2016, S. 5133–5145, doi:10.1007/s11164-015-2351-4.
- ↑ Bao Li, Alison E. Wendlandt, Shannon S. Stahl: Replacement of Stoichiometric DDQ with a Low Potential o -Quinone Catalyst Enabling Aerobic Dehydrogenation of Tertiary Indolines in Pharmaceutical Intermediates. In: Organic Letters. Band 21, Nr. 4, 15. Februar 2019, S. 1176–1181, doi:10.1021/acs.orglett.9b00111, PMID 30702297, PMC 6413530 (freier Volltext).
- ↑ Jun-Ho Choi, Kwang-Im Oh, Hochan Lee, Chewook Lee, Minhaeng Cho: Nitrile and thiocyanate IR probes: Quantum chemistry calculation studies and multivariate least-square fitting analysis. In: The Journal of Chemical Physics. Band 128, Nr. 13, 7. April 2008, doi:10.1063/1.2844787.
- ↑ Xi Wang, Yuanxun Wang, Xuemin Li, Zhenyang Yu, Chun Song, Yunfei Du: Nitrile-containing pharmaceuticals: target, mechanism of action, and their SAR studies. In: RSC Medicinal Chemistry. Band 12, Nr. 10, 2021, S. 1650–1671, doi:10.1039/D1MD00131K, PMID 34778767, PMC 8528211 (freier Volltext).
- ↑ Natalija Popović, Nicanor Morales-Delgado, David Vidal Mena, Antonia Alonso, María Pascual Martínez, María Caballero Bleda, Miroljub Popović: Verapamil and Alzheimer’s Disease: Past, Present, and Future. In: Frontiers in Pharmacology. Band 11, 5. Mai 2020, doi:10.3389/fphar.2020.00562, PMID 32431612, PMC 7214748 (freier Volltext).
- ↑ Ricky C.K. Cheng, Denis B. Tikhonov, Boris S. Zhorov: Structural Model for Phenylalkylamine Binding to L-type Calcium Channels. In: Journal of Biological Chemistry. Band 284, Nr. 41, Oktober 2009, S. 28332–28342, doi:10.1074/jbc.M109.027326, PMID 19700404, PMC 2788883 (freier Volltext).
- ↑ David R Bickers, Peter Calow, Helmut A Greim, Jon M Hanifin, Adrianne E Rogers, Jean-Hilaire Saurat, I Glenn Sipes, Robert L Smith, Hachiro Tagami: The safety assessment of fragrance materials. In: Regulatory Toxicology and Pharmacology. Band 37, Nr. 2, April 2003, S. 218–273, doi:10.1016/S0273-2300(03)00003-5.
- ↑ S.P. Bhatia, V.T. Politano, A.M. Api: Evaluation of genotoxicity of nitrile fragrance ingredients using in vitro and in vivo assays. In: Food and Chemical Toxicology. Band 59, September 2013, S. 784–792, doi:10.1016/j.fct.2013.04.040.
- ↑ H. W. Coover, D. W. Dreifus, J. T. O’Connor: Cyanoacrylate Adhesives. In: Handbook of Adhesives. Springer US, Boston, MA 1990, ISBN 978-1-4612-8019-4, S. 463–477, doi:10.1007/978-1-4613-0671-9_27.
- ↑ David García Cerdá, Antonio Martín Ballester, Alicia Aliena-Valero, Anna Carabén-Redaño, José M. Lloris: Use of cyanoacrylate adhesives in general surgery. In: Surgery Today. Band 45, Nr. 8, August 2015, S. 939–956, doi:10.1007/s00595-014-1056-4.
- ↑ Wie ein gewöhnlicher Zusatzstoff Lithium-Ionen-Batterien einen Schub verleiht. Chemie.de, 28. September 2022, abgerufen am 29. September 2022.
- ↑ Chao Tang, Yawei Chen, Zhengfeng Zhang, Wenqiang Li, Junhua Jian, Yulin Jie, Fanyang Huang, Yehu Han, Wanxia Li, Fuping Ai, Ruiguo Cao, Pengfei Yan, Yuhao Lu, Shuhong Jiao: Stable cycling of practical high-voltage LiCoO2 pouch cell via electrolyte modification. In: Nano Research. 2022, doi:10.1007/s12274-022-4955-5.